
【题目】写出下列反应的化学方程式和名称:
①1-溴丁烷与氢氧化钠乙醇溶液共热:_________________________________________________
②2-甲基-1,3-丁二烯与等物质的量的单质溴在60℃时发生1,4-加成反应:_________________
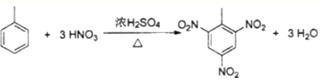
③甲苯制备TNT的反应:____________________________________________________
④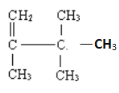 (用系统命名法命名) ____________________________________________
(用系统命名法命名) ____________________________________________
⑤ 2,6﹣二甲基﹣4﹣乙基辛烷(写出结构简式)_____________________________________
【答案】BrCH2CH2CH2CH3+NaOH![]() CH2=CHCH2CH3+NaBr+H2O
CH2=CHCH2CH3+NaBr+H2O 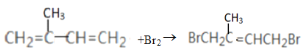
 2,3,3-三甲基-1-丁烯 CH3CH(CH3)CH2CH(CH2CH3)CH2CH(CH3)CH2CH3
2,3,3-三甲基-1-丁烯 CH3CH(CH3)CH2CH(CH2CH3)CH2CH(CH3)CH2CH3
【解析】
①1-溴丁烷与氢氧化钠乙醇溶液共热发生消去反应生成1-丁烯、溴化钠、水,反应方程式是BrCH2CH2CH2CH3+NaOH![]() CH2=CHCH2CH3+NaBr+H2O;
CH2=CHCH2CH3+NaBr+H2O;
②2-甲基-1,3-丁二烯与等物质的量的单质溴在60℃时发生1,4-加成反应生成![]() ,反应方程式是
,反应方程式是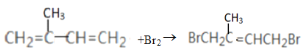 ;
;
③甲苯和浓硝酸、浓硫酸的混合物加热,生成2,4,6-三硝基甲苯,反应的方程式是 ;
;
④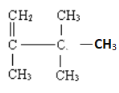 的官能团是碳碳双键,属于烯烃,名称是2,3,3-三甲基-1-丁烯;
的官能团是碳碳双键,属于烯烃,名称是2,3,3-三甲基-1-丁烯;
⑤ 2,6﹣二甲基﹣4﹣乙基辛烷的结构简式是CH3CH(CH3)CH2CH(CH2CH3)CH2CH(CH3)CH2CH3。


科目:高中化学 来源: 题型:
【题目】肼(N2H4)又称联氨,是火箭常用的高能燃料,常温下为液体,其球棍分子模型如图所示。肼能与双氧水发生反应 N2H4+2H2O2=N2+4H2O,用 NA表示阿伏加德罗常数的值。下列说法正确的是
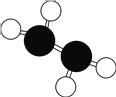
A.N2H4属于共价化合物,分子中只含有极性共价键
B.标准状况下,22.4 L N2H4中含有的原子总数为 6NA
C.标准状况下,3.2 g N2H4中含有共价键的总数为 0.6NA
D.若生成 3.6g H2O,则上述反应转移电子的数目为 0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中各组物质之间不能通过一步反应实现如图的是( )
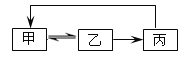
甲 | 乙 | 丙 | |
A | NaHCO3 | Na2CO3 | NaCl |
B | SiO2 | H2SiO3 | Na2SiO3 |
C | Cl2 | HCl | CuCl2 |
D | AlCl3 | Al(OH)3 | Al2O3 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次发生的反应类型和反应条件都正确的是
选项 | 反应类型 | 反应条件 |
A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg-H2O2电池可用于驱动无人驾驶的潜航器。该电池以海水为电解质溶液,示意图如下。该电池工作时,下列说法正确的是( )

A. Mg 电极是该电池的正极
B. H2O2在石墨电极上发生氧化反应
C. 石墨电极附近溶液的pH 增大
D. 溶液中Cl-向正极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醛是一种化工原料。某实验小组利用如下装置合成正丁醛。发生的反应如下:
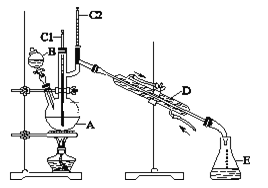
CH3CH2CH2CH2OH![]() CH3CH2CH2CHO ,反应物和产物的相关数据列表如下:
CH3CH2CH2CHO ,反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.810 9 | 微溶 |
正丁醛 | 75.7 | 0.801 7 | 微溶 |
实验步骤如下:将6.0 g Na2Cr2O7放入100 mL烧杯中,加30 mL水溶解,与5 mL浓硫酸形成混合溶液,将所得溶液小心转移至B中。在A中加入4.0 g正丁醇和几粒沸石,加热。当有蒸气出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95 ℃,在E中收集90 ℃以下的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77 ℃馏分,产量3.2g。
回答下列问题:
(1)实验中,Na2Cr2O7溶液和浓硫酸添加的顺序为__________________________。
(2)若加热后发现未加沸石,应采取的正确方法是___________________________。
(3)上述装置图中,E仪器的名称是________________________。 B使用前必须进行的操作是_____________。
(4)检验粗产品中的正丁醛的方法________________________________________。(用适当的文字和反应方程式表达)
(5)反应温度应保持在90~95 ℃,其原因是__________________________________
(6)本实验中,正丁醛的产率为_______________ %(结果保留两位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍钴锰酸锂电池是一种高功率动力电池。采用废旧锂离子电池回收工艺制备镍钴锰酸锂三元正极材料(铝电极表面涂有LiNi1-x-yCoxMnyO2)的工艺流程如图所示:
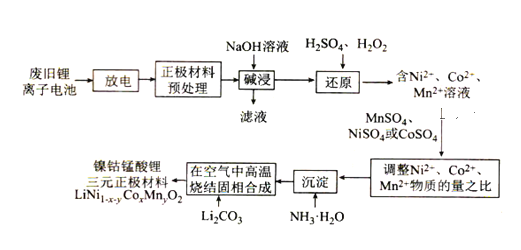
回答下列问题
(1)废旧锂离子电池拆解前进行“放电处理”有利于锂在正极的回收,其原因是___。
(2)能够提高“碱浸”效率的方法有___(至少写两种)。
(3)“碱浸”过程中,铝溶解,在该反应中每产生1mol非极性共价键放出133.3kJ的热量,请写出该反应的热化学方程式___。
(4)实验室模拟“碱浸”后过滤的操作,过滤后需洗涤,简述洗涤的操作过程:___。
(5)LiCoO2参与“还原”反应的离子方程式为___。在该反应中H2O2做___(氧化剂,还原剂)1molH2O2参与反应转移__ NA个电子
(6)溶液温度和浸渍时间对钴的浸出率影响如图所示,则浸出过程的最佳条件是___。
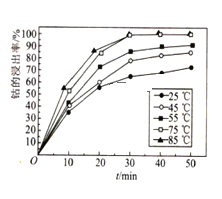
(7)已知溶液中Co2+的浓度为1.0mol·L-1,缓慢通入氨气,使其产生Co(OH)2沉淀,则Co2+沉淀完全时溶液的最小pH为____(已知:离子沉淀完全时c(Co2+)≤1.0×10-5mol·L-1,Ksp[Co(OH)2]=4.0×10-15,1g5=0.7,1g2=0.3,溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】小强同学利用图甲所示的裝置测定空气中氧气的含量,其中燃烧匙内的白磷用电加热装置点燃,瓶內气压用气体压强传感器测定,其变化如图乙所示,回答相关问题。
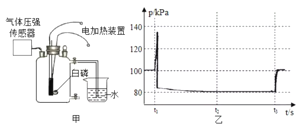
(1)下列关于图甲实验的说法正确的是(________)
A.实验前先检査装置气密性,再装入少量白磷
B.红磷燃烧,产生大量白雾,放热
C.甲装置密闭,可以减小空气污染
D.本实验可以证明空气含有N2、O2、CO2和稀有气体
(2)图乙中,t3时刻瓶内气压又显著增加,这是因为进行了一个实验操作,即___。
(3)小强同学对实验装置进行了改进:选用容积为45mL的试管做反应容器进行实验,如图丙所示。
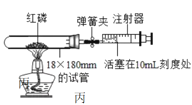
①实验前检查装置的气密性,具体操作为:组装好装置,打开弹簧夹,将活塞往前轻轻推一段距离,松手后,观察到___,则装置气密性良好。
②如果实验一切正常,则实验结束后打开弹簧夹,注射器活塞将从10mL刻度处慢慢前移到约___mL刻度处才停止。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】固体化合物X由3种元素组成。某学习小组进行了如下实验:

请回答:
(1) 由现象1得出化合物X含有________元素(填元素符号)。
(2) 固体混合物Y的成分________(填化学式)。
(3) X的化学式________。X与浓盐酸反应产生黄绿色气体,固体完全溶解,得到蓝色溶液,该反应的化学方程式是________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com