
【题目】25℃时,三种酸的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
回答下列问题:
(1)一般情况下,当温度升高时,Ka________(填“增大”、“减小”或“不变”)。
(2)下列四种离子结合H+能力由大到小的顺序是______________________(填字母)。
a.CO32- b.ClO- c.CH3COO- d.HCO3-
(3)下列反应不能发生的是________(填字母)。
a. CO32-+2CH3COOH=2CH3COO-+CO2↑+H2O
b. ClO-+CH3COOH=CH3COO-+HClO
c. CO32-+2HClO=CO2↑+H2O+2ClO-
d. 2ClO-+CO2+H2O=CO32-+2HClO
(4)用蒸馏水稀释醋酸,下列各式表示的数值随水量的增加而增大的是______(填字母)。
a.c(CH3COOH)/c(H+) b. c(CH3COO-)/c(CH3COOH) c. c(H+)/Ka d.c(H+)/c(OH-)
(5)体积均为10 mL、pH均为2的醋酸溶液与HX溶液分别加水稀释至1000 mL,稀释过程中pH变化如下图所示。
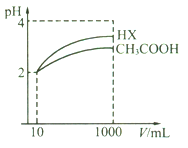
则HX的电离平衡常数________(填“>”、“=”或“<”,下同)醋酸的电离平衡常数;稀释后,HX溶液中水电离出来的c(H+)_____醋酸溶液中水电离出来的c(H+);用同浓度的NaOH溶液分别中和上述两种酸溶液,恰好中和时消耗NaOH溶液的体积:醋酸____HX。
(6)25℃时,测得CH3COOH与CH3COONa的混合溶液pH=6,则溶液中c(CH3COO-)-c(Na+)=________mol·L-1(填精确数值)。
【答案】增大 a>b>d>c cd b > > > 9.9×10-7 moL·L-1
【解析】
(1)弱电解质的电离一般是吸热的过程,升高温度,Ka增大;
(2)酸性越强,酸根离子结合氢离子的能力越弱,据此分析;
(3)由以上分析可知酸性强弱顺序为CH3COOH>H2CO3>HClO>HCO3-,根据强酸制弱酸的规律进行判断;
(4)醋酸属于弱电解质,加水稀释后促进了醋酸的电离,使n(H+)、n(CH3COO-)增大,n(CH3COOH)减小,但加水以后溶液的体积增大,导致c(H+)、c(CH3COO-)、c(CH3COOH)减小,据此分析问题;
(5)等体积、等pH的不同一元酸稀释相同的倍数,pH数值变化较大的是强酸,变化较小的是弱酸,酸性越强,电离平衡常数就越大;用同浓度的氢氧化钠与两溶液反应,消耗氢氧化钠的体积与物质的量成正比;
(6)依据电荷守恒进行计算。
(1)弱电解质的电离一般是吸热的过程,升高温度,Ka增大;
(2)电离常数越大,越容易电离,因而酸性强弱有CH3COOH>H2CO3>HClO>HCO3-,酸性越强,酸根离子结合氢离子的能力越弱,那么结合质子的能力大小关系为:CO32->ClO->HCO3->CH3COO-,即a>b>d>c ;
(3)由以上分析可知酸性强弱顺序为CH3COOH>H2CO3>HClO>HCO3-,
a. CH3COOH>H2CO3,反应可以发生,a项错误;
b. CH3COOH>HClO,反应可以发生,b项错误;
c. H2CO3>HClO,反应不能发生,c项正确;
d. H2CO3>HClO>HCO3-,反应不能发生,应生成HCO3-和HClO,d项正确;
答案选cd。
(4)醋酸属于弱电解质,加水稀释后促进了醋酸的电离,使n(H+)、n(CH3COO-)增大,n(CH3COOH)减小,但加水以后溶液的体积增大,导致c(H+)、c(CH3COO-)、c(CH3COOH)减小;
a. H+物质的量增大, CH3COOH物质的量减小,故c(CH3COOH)/c(H+)的比值减小,a项错误;
b. CH3COO-物质的量增大, CH3COOH物质的量减小,故c(CH3COO-)/c(CH3COOH)的比值增大,b项增大;
c. c(H+)减小,温度不变,水的离子积常数不变,则c(H+)/Ka的比值减小,c项错误;
d. c(H+)减小,温度不变,水的离子积常数不变,则c(OH-)增大,有c(H+)/c(OH-)的比值减小,d项错误;
答案选b;
(5)等体积、等pH的不同一元酸稀释相同的倍数,pH数值变化较大的是较强的酸,变化较小的是较弱的酸,故酸性HX>CH3COOH;酸性越强,电离平衡常数就越大,因而电离平衡常数HX>CH3COOH;酸能抑制水的电离,c(H+)越大越抑制水的电离,则稀释后c(H+):CH3COOH>HX,即HX溶液中水电离出来的c(H+)>醋酸溶液中水电离出来的c(H+);用同浓度的氢氧化钠与两溶液反应,消耗氢氧化钠的体积与物质的量成正比,pH相同,体积相同的这两种酸的物质的量CH3COOH>HX,即消耗NaOH溶液的体积:CH3COOH>HX;
(6)CH3COOH与CH3COONa的混合溶液pH=6,说明c(H+)=10-6mol/L,c(OH-)=10-8mol/L,根据电荷守恒有:c(CH3COO-)+ c(OH-)= c(H+)+ c(Na+),那么c(CH3COO-)- c(Na+) = c(H+)- c(OH-)=10-6mol/L-10-8mol/L=9.9×10-7 mol/L.


科目:高中化学 来源: 题型:
【题目】下列解释事实或实验现象的化学用语正确的是
A. 硫酸酸化的KI淀粉溶液久置后变蓝:4I-+O2 + 4H+ ![]() 2I2+2H2O
2I2+2H2O
B. 铁和稀硝酸反应制得浅绿色溶液:Fe + 4H+ + NO3-![]() Fe3+ + NO↑+ 2H2O
Fe3+ + NO↑+ 2H2O
C. 水垢上滴入CH3COOH溶液有气泡产生:CaCO3+2H+ ![]() Ca2++CO2↑+ H2O
Ca2++CO2↑+ H2O
D. SO2通入漂白粉溶液中产生白色浑浊:SO2+Ca2++2ClO-+H2O ![]() CaSO3↓+2HClO
CaSO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
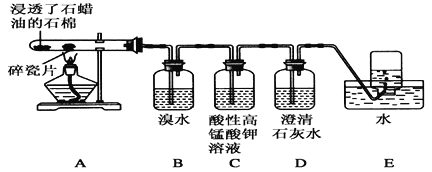
【题目】某同学设计实验探究工业制乙烯的原理和乙烯的主要化学性质,实验装置如图所示(已知烃类都不与碱反应)。请回答下列问题:
(1)工业制乙烯的实验原理是烷烃(液态)在催化剂和加热条件下发生反应生成不饱和烃。例如,石油分馏产物之一的十六烷烃发生反应:C16H34![]() C8H18+甲,甲
C8H18+甲,甲![]() 4乙,则甲的分子式为________,乙的结构简式为____________________________________。
4乙,则甲的分子式为________,乙的结构简式为____________________________________。
(2)B装置中的实验现象可能是________,写出反应的化学方程式:__________,其反应类型是________。
(3)C装置中可观察到的现象是____________,反应类型是________。
(4)查阅资料知,乙烯与酸性高锰酸钾溶液反应产生二氧化碳。根据本实验中装置_____(填字母)中的实验现象可判断该资料是否真实。为了探究溴与乙烯反应是加成反应而不是取代反应,可以测定装置B中溶液在反应前后的酸碱性,简述其理由: __________________。
(5)通过上述实验探究,检验甲烷和乙烯的方法是________(选填字母,下同);除去甲烷中乙烯的方法是________。
A.气体通入水中 B.气体通过盛溴水的洗气瓶
C.气体通过盛酸性高锰酸钾溶液的洗气瓶 D.气体通过氢氧化钠溶液
(6)分别燃烧乙烯和甲烷,甲烷火焰明亮而乙烯产生少量黑烟,原因是_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种瓦斯分析仪(下图甲)能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如下图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。下列有关叙述正确的的是( )

A. 瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
B. 电极a的反应式为:CH4+5O2-―8e-=CO32- +2H2O
C. 电极b是正极, O2-由电极a流向电极b
D. 当固体电解质中有1 mol O2-通过时,电子转移4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
(1)CaO可在较高温度下捕集CO2,在更高温度下将捕集的CO2释放利用。CaC2O4·H2O热分解可制备CaO,CaC2O4·H2O加热升温过程中固体的质量变化见下图。
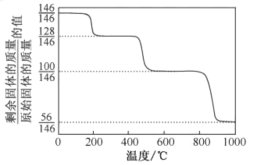
①写出400~600 ℃范围内分解反应的化学方程式:________。
②与CaCO3热分解制备的CaO相比,CaC2O4·H2O热分解制备的CaO具有更好的CO2捕集性能,其原因是________。
(2)电解法转化CO2可实现CO2资源化利用。电解CO2制HCOOH的原理示意图如下。
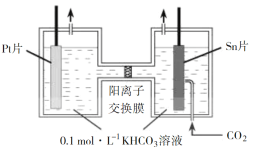
①写出阴极CO2还原为HCOO的电极反应式:________。
②电解一段时间后,阳极区的KHCO3溶液浓度降低,其原因是________。
(3)CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH =41.2 kJ·mol1
CO(g)+H2O(g) ΔH =41.2 kJ·mol1
反应Ⅱ:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol1
CH3OCH3(g)+3H2O(g) ΔH =﹣122.5 kJ·mol1
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:

CH3OCH3的选择性=![]() ×100%
×100%
①温度高于300 ℃,CO2平衡转化率随温度升高而上升的原因是________。
②220 ℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在反应A(g)+3B(g)=2C(g)中,若以物质A表示的该反应的化学反应速率为0.2 mol·L1·min1,则以物质B表示此反应的化学反应速率为________mol·L1·min1。
(2)在2 L的密闭容器中,充入2 mol N2和3 mol H2,在一定条件下发生反应,3 s后测得N2为1.9 mol,则以H2的浓度变化表示的反应速率为____________________________。
(3)将10 mol A和5 mol B放入容积为10 L的密闭容器中,某温度下发生反应:3A(g)+B(g) ![]() 2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L1·s1,则在2 s时,容器中有______ mol A,此时C的物质的量浓度为________。
2C(g),在最初2 s内,消耗A的平均速率为0.06 mol·L1·s1,则在2 s时,容器中有______ mol A,此时C的物质的量浓度为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L的密闭容器中,加入1mol X(g)和2 mol Y(g)发生反应:X(g)+mY(g)![]() 3Z(g) ΔH<0,平衡时,X和Y的转化率都是10%。下列叙述不正确的是
3Z(g) ΔH<0,平衡时,X和Y的转化率都是10%。下列叙述不正确的是
A.m=2
B.达平衡时,Z的体积分数为10%
C.达平衡后,保持容器体积不变,加热,容器内压强将增大
D.将平衡后的容器体积压缩至1L,X的浓度为0.45mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组同学自酿米酒,具体步骤如下:
![]()
定时监测获得的实验数据图如下:

下列说法不正确的是
A.糯米中淀粉在酒曲中糖化酶作用下水解为葡萄糖,葡萄糖在酒化酶作用下转化为乙醇
B.酿造过程中米酒 pH 逐渐下降,可能是因为部分乙醇被空气氧化为乙酸
C.从第 7 天开始米酒的酒精度近乎不变,说明溶液中的葡萄糖已经完全反应
D.该小组最终酿出的米酒酒精度不高,可采用蒸馏法提高酒精度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为氟利昂(如CFCl3)破坏臭氧层的反应过程示意图,下列说法不正确的是
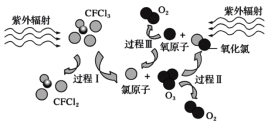
A.过程Ⅰ中断裂极性键C—Cl键
B.过程Ⅲ中O+O == O2是吸热过程
C.过程Ⅱ可表示为O3+Cl==ClO+O2
D.上述过程说明氟利昂中氯原子是破坏O3的催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com