
 .
. .
. 分析 A、B、C、D、E五种短周期元素,它们的原子序数依次增大.B元素原子L层上的电子数为K层电子数的2倍,则B原子L层电子数为4,所以B为C元素;元素D的2价阴离子的核外电子排布与氖原子相同,则D为O元素;C的原子序数介于碳元素与氧元素之间,所以C为N元素;A与E同主族,原子序数A<E,A和E这两种元素与D(氧)都能形成X2Y、X2Y2型化合物,则A为H元素,E为Na元素,据此进行解答.
解答 解:A、B、C、D、E五种短周期元素,它们的原子序数依次增大.B元素原子L层上的电子数为K层电子数的2倍,则B原子L层电子数为4,所以B为C元素;元素D的2价阴离子的核外电子排布与氖原子相同,则D为O元素;C的原子序数介于碳元素与氧元素之间,所以C为N元素;A与E同主族,原子序数A<E,A和E这两种元素与D(氧)都能形成X2Y、X2Y2型化合物,则A为H元素,E为Na元素,
(1)由上述分析可知,A为H元素,B为C元素,C为N元素,E为Na,
故答案为:H;C;N;Na;
(2)D为O元素,其原子序数为8,氧原子的原子结构示意图为: ,
,
故答案为: ;
;
(3)E、D分别为Na、O元素,二者形成X2Y型化合物为Na2O,氧化钠为离子化合物,其电子式为 ,
,
故答案为: .
.
点评 本题考查了无机物推断,题目难度中等,根据物质之间的反应、物质的性质等知识点确定物质,再结合物质的结构分析解答,同时考查学生分析问题、解决问题的能力.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 原子半径:W<Y<Z | |
| B. | 简单气态氢化物的热稳定性:Z>Y>W | |
| C. | W、X能形成两种化合物,其中一种与水反应生成气体 | |
| D. | 四种元素中,Z的最高价氧化物对应的水化物酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
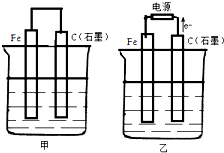 如图甲、乙是电化学实验装置.
如图甲、乙是电化学实验装置.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
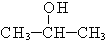 +O2$→_{△}^{催化剂}$2
+O2$→_{△}^{催化剂}$2 +2H2O,产物不发生银镜反应;
+2H2O,产物不发生银镜反应; +H2$→_{△}^{催化剂}$
+H2$→_{△}^{催化剂}$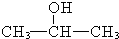 .
.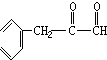 ,G与M是由不同方式形成的高分子化合物.
,G与M是由不同方式形成的高分子化合物.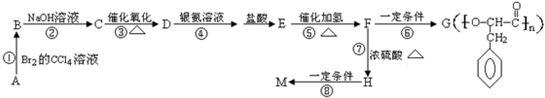
 .
.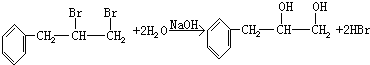 ,取代反应;
,取代反应; ,加聚反应.
,加聚反应.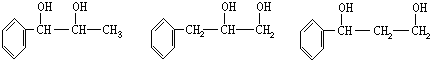
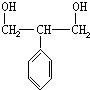 ,
,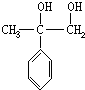 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
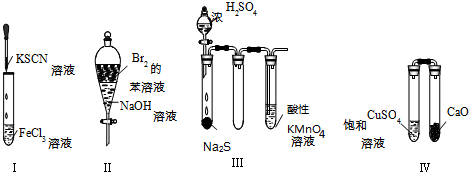
| A. | 实验Ⅰ:试管中溶液颜色变为红色 | |
| B. | 实验Ⅱ:振荡后静置,上层溶液颜色保持不变 | |
| C. | 实验Ⅲ:酸性KMnO4溶液中出现气泡,但颜色不会褪去 | |
| D. | 实验Ⅳ:放置一段时间后,饱和CuSO4溶液中出现蓝色晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| B | 短周期主族元素中原子半径最大 |
| C | 单质为双原子分子,是空气的主要成分,化学性质稳定 |
| D | 元素最高正价是+7价 |
| E | M层上有6个电子 |
 ;元素E与元素D相比,非金属性较强的是Cl(用元素符号表示),下列实验能证明这一事实的是B(填序号).
;元素E与元素D相比,非金属性较强的是Cl(用元素符号表示),下列实验能证明这一事实的是B(填序号).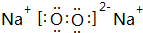 ,其中含有离子、非极性键(填“离子”、“极性”或“非极性”);该化合物加入FeCl2溶液中,产生红褐色沉淀,但无气体产生,试写出该反应的离子方程式3Na2O2+6Fe2++6 H2O=4Fe(OH)3+2Fe3++6Na+.
,其中含有离子、非极性键(填“离子”、“极性”或“非极性”);该化合物加入FeCl2溶液中,产生红褐色沉淀,但无气体产生,试写出该反应的离子方程式3Na2O2+6Fe2++6 H2O=4Fe(OH)3+2Fe3++6Na+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁制品表面镀锌可以增强其抗腐蚀性 | |
| B. | 在海轮外壳上连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法 | |
| C. | 马口铁(镀锡)外层镀层被破坏后,里面的铁更易被腐蚀 | |
| D. | 利用外加电流的阴极保护法,可以将水下的钢闸门与电源正极相连 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com