(2011?唐山模拟)在海底和青藏高原都发现了名为“可燃冰”的环保型新能源,主要成分是CH
4,CH
4在光照下可与Cl
2反应,也可以用CH
4和H
2O为原料制备二甲醚和甲醇等新型燃料.
(1)CH
4可与Cl
2反应,其反应机理如下:
(2)Cl2→2Cl2△H=+243kJ?mol-1
①
Cl2→2Cl △H=+243KJ? mol-1②
Cl+CH4→CH3+HCl △H=+4KJ?mol-1③
CH3+Cl2→CH3Cl+Cl △H=-106KJ?mol-1则CH
4与Cl
2反应生成CH
3Cl(g)的热化学方程式为:
(2)在一定条件下,发生反应:CH
4(g)+H
2O(g)
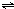
ClO(g)+3H
2(g)△H>0.
在其它条件不变的情况下降低温度,逆反应速率将
减小
减小
(填“增大”、“减小”或“不变”).若在2L密闭容器中发生反应,T℃时,通入2mol CH
4(g)和2mol H
2O(g),反应达平衡后,生成l mol CO,此时向容器中同时加入1mol CO和3molH
2的混合气体(保持温度不变),则平衡将
向逆反应方向
向逆反应方向
(填“向正反应方向”、“向逆反应方向”或“不”)移动,达到新平衡后平衡常数
不变
不变
(3)CH
4(g)和H2O(g)生成的CO和H
2在一定条件下可发生反应CO(g)+2H
2(g)
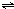
CH
3OH(g)△H=-90.1kJ?mol-1,恒容条件下达平衡,下列措施中能使n(CH
3OH)/n(CO)增大的有
a
a
.(选填序号).
a.再充入1mol H
2 b.使用健化剂 c.再充入2mol CO d.升高温度
(4)CH
4可用于设计燃料电池,甲烷燃料电池的工作原理如下图所示:

则正极的电极反应式为:
O2+4e-+2H2O=4OH-
O2+4e-+2H2O=4OH-
;
反应一段时间后溶液的pH
降低
降低
(填“升高”、“降低”或“不变”).

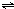 ClO(g)+3H2(g)△H>0.
ClO(g)+3H2(g)△H>0.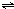 CH3OH(g)△H=-90.1kJ?mol-1,恒容条件下达平衡,下列措施中能使n(CH3OH)/n(CO)增大的有
CH3OH(g)△H=-90.1kJ?mol-1,恒容条件下达平衡,下列措施中能使n(CH3OH)/n(CO)增大的有
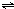 CO(g)+3H2(g)
CO(g)+3H2(g)

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案