
【题目】某溶液中,只含有下表中所示的四种离子,则X离子及其个数b可能为( )
离子 | Na+ | Al3+ | Cl- | X |
个数 | 3a | 3a | 2a | b |
A.![]() 、4aB.
、4aB.![]() 、4aC.
、4aC.![]() 、8aD.
、8aD.![]() 、5a
、5a
【答案】D
【解析】
由电荷守恒可知X为阴离子,OH-与Al3+不能大量共存,故X不可能为OH-,其它阴离子均能与阳离子共存,根据溶液呈电中性原则,溶液中阳离子所带电荷总数等于阴离子所带电荷总数。
A.NO3-离子均能与阳离子共存,阳离子总电量=3a+3a×3=12a,阴离子总电量=2a+4a×1=6a,电荷不守恒,故A错误;
B.SO42-离子均能与阳离子共存,阳离子总电量=3a+3a×3=12a,阴离子总电量=2a+4a×2=10a,电荷不守恒,故B错误;
C.OH-与Al3+生成氢氧化铝沉淀,不能大量共存,故X不可能为OH-,故C错误;
D.SO42-离子均能与阳离子共存,阳离子总电量=3a+3a×3=12a,阴离子总电量=2a+5a×2=12a,电荷守恒,故D正确;
故选D。


 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案科目:高中化学 来源: 题型:
【题目】如图为工业从海水中提取液溴的流程图:
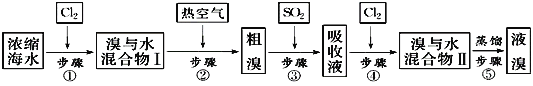
已知:溴的沸点为59℃,微溶于水,有毒性。请回答:
(1)某同学利用下图装置进行步骤①至步骤④的实验,当进行步骤①时,应关闭活塞___,打开活塞____。
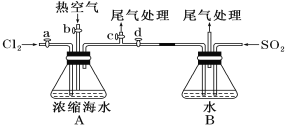
(2)步骤②中可根据___现象,简单判断热空气的流速。
(3)步骤③中简单判断反应完全的依据是___。
(4)从“溴水混合物Ⅰ”到“溴水混合物Ⅱ”的目的是___。
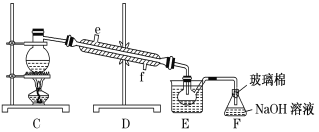
(5)步骤⑤用下图装置进行蒸馏,蒸馏烧瓶中尚未安装温度计,安装其位置时应注意___,装置C中直接加热不合理,应改为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的结构简式如如图。

(1)请写出该物质的含氧官能团名称______、______和______。
(2)请写出以下化学反应的方程式:
①A跟NaOH溶液反应:__________
②A跟NaHCO3溶液反应:__________
③A在一定条件下跟Na反应:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )
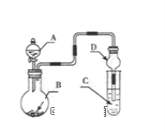
A.若A为浓盐酸,B为Na2SO3,C中盛有Na2SiO3溶液,C中溶液出现白色沉淀,证明酸性:H2SO3> H2SiO3
B.若A为浓盐酸,B为MnO2,C中盛有KI淀粉溶液,C中溶液变蓝色
C.若A为浓氨水,B为生石灰,C中盛有AlCl 3溶液,C中先产生白色沉淀后沉淀溶解
D.若A为H2O2,B为MnO2,C中盛有Na2S溶液,C中溶液变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
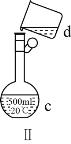
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为两套实验装置。
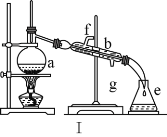
(1)写出下列仪器的名称:a.____,b._____,c.____。
(2)仪器ae中,使用前必须检查是否漏水的有____(填序号)。
(3)若利用装置Ⅰ分离四氯化碳和酒精的混合物,温度计水银球的位置在____处。冷凝水由(填“f”或“g”,下同)____口通入,_____口流出。
(4)现需配制0.13mol·L1NaOH溶液450mL,装置Ⅱ是某同学转移溶液的示意图。
①根据计算用托盘天平称取NaOH溶液的质量为_____g。为完成此溶液配制实验需要的玻璃仪器有______。
②图Ⅱ中的错误是_____。
③配制时,按以下几个步骤进行:计算、称量、溶解、冷却、转移、定容、摇匀、装瓶。操作中还缺少一个重要步骤是_____。
④取用任意体积的该NaOH溶液时,下列物理量中不随所取体积的多少而变化的是_____(填字母)。
A.溶液中Na的物质的量 B.溶液的浓度
C.NaOH的溶解度 D.溶液的密度
⑤下面操作造成所配NaOH溶液浓度偏高的是_____。
A.暴露在空气中称量NaOH的时间太长
B.将砝码放在左盘上, NaOH放在右盘上进行称量(使用游码)
C.向容量瓶转移液体时,容量瓶内含有蒸馏水
D.溶解后未冷却至室温就转移至容量瓶
E.转移液体时玻璃棒的下端放在容量瓶刻度线以上处
F.定容时,加蒸馏水超过刻度线,又用胶头滴管吸出
G.定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】多晶硅是制作光伏电池的关键材料。以下是由粗硅制备多晶硅的简易过程。

回答下列问题:
Ⅰ.硅粉与![]() 在300℃时反应生成
在300℃时反应生成![]() 气体和
气体和![]() ,放出
,放出![]() 热量,该反应的热化学方程式为_____________。
热量,该反应的热化学方程式为_____________。![]() 的电子式为__________________。
的电子式为__________________。
Ⅱ.将![]() 氢化为
氢化为![]() 有三种方法,对应的反应依次为:
有三种方法,对应的反应依次为:
①![]()
![]()
②![]()
![]()
③![]()
![]()
(1)氢化过程中所需![]() 高纯度
高纯度![]() 可用惰性电极电解
可用惰性电极电解![]() 溶液制备,写出产生
溶液制备,写出产生![]() 的电极名称______(填“阳极”或“阴极”),该电极反应方程式为_______________。
的电极名称______(填“阳极”或“阴极”),该电极反应方程式为_______________。
(2)反应③的![]() _______________(用
_______________(用![]() ,
,![]() 表示)。
表示)。
(3)由粗硅制备多晶硅过程中循环使用的物质除![]() 、
、![]() 和
和![]() 外,还有______(填分子式)。
外,还有______(填分子式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某二元酸(H2A)在水中的电离方程式为:H2A=H++HA-,HA-H++A2-(Ka=1.0×10-2),下列说法正确的是
A. 在0.1mol/L的H2A溶液中,c(H+)=0.2mol/L
B. 在0.1mol/L的Na2A溶液中,c(A2-)+c(HA-)+c(H2A)=0.1mol/L
C. 0.1mol/L的NaHA溶液中离子浓度为:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
D. 分别将浓度均为0.1mol/L的NaHA和Na 2A溶液等体积混合,其pH一定大于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下列说法不正确的是_____________(填字母代码)。
A.对于Al(OH)3(s) |
B.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的 |
C.能源、信息与材料通常被称为现代社会发展的三大支柱 |
D.镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易被腐蚀 |
E.除去硬水中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2溶解度比 MgCO3的小
II.向含有AgI的饱和溶液中:
(1)加入固体AgNO3,则c(I-)________(填“变大”、“变小”或“不变”,下同)。
(2)若改加更多的AgI,则c(Ag+)___________。
(3)若改加AgCl固体,则c(I-)___________,而c(Ag+)___________。
III.用“>”、“<”或“=”填空:
(1)25℃时1mol/L FeCl3溶液的pH______80℃时1mol/L FeCl3溶液的pH。
(2)已知NaHSO3溶液中c(HSO3-)>c(SO32-)>c(H2SO3),则溶液中c(H+)______c(OH-)。
(3)常温下,取等物质的量浓度的HA溶液与NaOH溶液等体积混合,测得混合溶液的pH=8,混合溶液中由水电离出的c(H+)水______NaOH溶液中由水电离出的c(H+)水。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水AlCl3易升华,可用作有机合成的催化剂等。工业上以铝土矿(Al2O3、Fe2O3)为原料制备无水AlCl3的工艺流程如下:

(1) 氯化炉中Al2O3、Cl2和C反应的化学方程式为____________________。
(2)用Na2SO3溶液可除去冷却器排出的尾气中的Cl2,此反应的离子方程式为__________。
(3)升华器中主要含有AlCl3和FeCl3,需加入少量Al,其作用是________。
(4)为测定制得的无水AlCl3产品(含杂质FeCl3)的纯度,称取16.25 g无水AlCl3样品,溶于过量的NaOH溶液中,过滤出沉淀物,沉淀物经洗涤、灼烧、冷却、称重,得其质量为0.32 g。
① 写出上述除杂过程中涉及的离子方程式___________、____________。
② AlCl3产品的纯度为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com