
【题目】图1表示K、Cu、Si、H、C、N六种元素单质的熔点高低,其中c、d均是热和电的良导体,e常作为半导体材料。下列说法错误的是( )
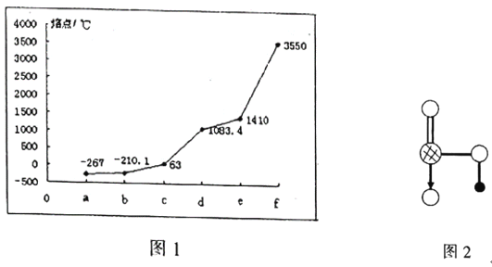
A.d的硫酸盐溶液呈酸性
B.a元素与b元素可形成核外电子总数为8的分子
C.图2为上述六种元素中的一种元素形成的含氧酸的结构
D.e单质能与c的最高价氧化物对应水化物的溶液发生反应
科目:高中化学 来源: 题型:
【题目】常温下,用NaOH溶液滴定H2C2O4溶液,溶液中-1g[c(H+)/c(H2C2O4)]和-1gc(HC2O![]() )或-1g[c(H+)/c(HC2O
)或-1g[c(H+)/c(HC2O![]() )]和-lgc(C2O
)]和-lgc(C2O![]() )关系如图所示,下列说法错误的是
)关系如图所示,下列说法错误的是
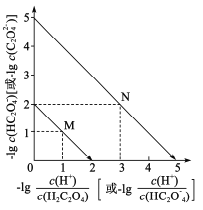
A.曲线M表示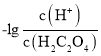 和
和![]() 的关系
的关系
B.滴定过程中,当pH=5时,c(Na+)-3c(HC2O![]() )>0
)>0
C.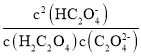 随pH的升高而减小
随pH的升高而减小
D.在NaHC2O4溶液中c(Na+)>(HC2O![]() )>c(C2O
)>c(C2O![]() )>c(H2C2O4)
)>c(H2C2O4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知2 mol氢气燃烧生成液态水时放出572 kJ热量,反应方程式是
2H2(g)+O2(g)==2H2O(l)
(l)请回答下列问题:
①该反应的生成物能量总和________(填“大于”、“小于”或“等于”)反应物能量总和。
②若2 mol氢气完全燃烧生成水蒸气,则放出的热量________(填“>”、“<”或“=”)572 kJ。
③与化石燃料相比,利用氢能源有很多优点,请说出其中一点______________________。
(2)FeS2焙烧产生的SO2可用于制硫酸。已知25 ℃、101 kPa时:
2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=-197 kJ·mol-1;
2SO3(g) ΔH1=-197 kJ·mol-1;
H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1;
2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l)ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应A(g)+3B(g)![]() 2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
2C(g),下列各数据表示不同条件下的反应速率,其中反应进行得最快的是
A.v(A)=0.01mol/(L·s)B.v(B)=0.02mol/(L·s)
C.v(B)=0.60mol/(L·min)D.v(C)=1.00mol/(L·min)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】喘通(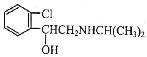 )是我国最早自主研发生产的药物之一,主要用于支气管哮喘的治疗。其合成路线如图:
)是我国最早自主研发生产的药物之一,主要用于支气管哮喘的治疗。其合成路线如图:
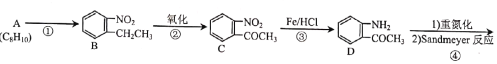
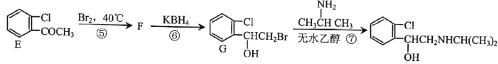
(1)A的化学名称为___,反应①的试剂与条件为__,反应③的反应类型为___。
(2)E中含氧官能团的名称为__。
(3)F的结构简式为___。
(4)反应⑦的化学方程式为__。
(5)B的同分异构体H是含有氨基、能与NaHCO3溶液反应放出气体的芳香族化合物。则H的结构有__种(不含立体异构)。其中核磁共振氢谱有5组峰,且峰面积之比为1:2:2:2:2的是__(写出其中一种的结构简式)。
(6)《神农本草经》中记载麻黄能“止咳逆上气”。从麻黄中提取的麻黄碱也可用于治疗支气管哮喘,其结构简式为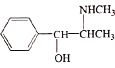 。
。
已知:![]() + CH3COCl
+ CH3COCl![]() +HCl。设计以苯、CH3CH2COCl、CH3NH2为原料合成麻黄碱的合成路线__。(无机试剂任选)
+HCl。设计以苯、CH3CH2COCl、CH3NH2为原料合成麻黄碱的合成路线__。(无机试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磁铁矿石的主要成分是四氧化三铁(化学式Fe3O4)根据它的化学式计算:
(1)四氧化三铁中铁元素和氧元素的质量比。__________________
(2)1 000 t四氧化三铁中含有铁元素的质量是多少吨。____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷化镓![]() 为黑灰色固体,是重要的半导体材料,用砷化镓制成的半导体器件具有低温性能好、抗辐射能力强等优点。请回答下列问题:
为黑灰色固体,是重要的半导体材料,用砷化镓制成的半导体器件具有低温性能好、抗辐射能力强等优点。请回答下列问题:
(1)基态![]() 原子核外电子占据最高能级的电子云轮廓图为________形。
原子核外电子占据最高能级的电子云轮廓图为________形。
(2)砷化镓可由![]() 和
和![]() 制得。在常温常压下,
制得。在常温常压下,![]() 为无色透明液体,则
为无色透明液体,则![]() 固体属于________晶体。
固体属于________晶体。![]() 的沸点低于
的沸点低于![]() 的原因为________。
的原因为________。
(3)亚砷酸![]() 是一种三元弱酸,分子中含有羟基数目为________个;根据价层电子对互斥理论推测
是一种三元弱酸,分子中含有羟基数目为________个;根据价层电子对互斥理论推测![]() 的空间构型为________;与
的空间构型为________;与![]() 互为等电子体的一种分子为________。
互为等电子体的一种分子为________。
(4)![]() 的熔点为
的熔点为![]() ,晶胞结构如图所示:
,晶胞结构如图所示:
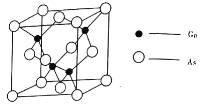
①在![]() 晶体中,镓原子的配位数是________,与同一个镓原子相连的砷原子构成的空间构型为________。
晶体中,镓原子的配位数是________,与同一个镓原子相连的砷原子构成的空间构型为________。
②若砷化镓晶胞边长为![]() 。则该晶体密度为________
。则该晶体密度为________![]() (用含
(用含![]() 的代数式表示)。
的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,若电解5min时铜电极质量增加2.16g,试回答(硝酸银足量):
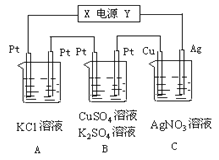
(1)电源电极X名称为____。
(2)通电5min时,B中共收集到224mL气体(标况),溶液体积为200mL,则通电前硫酸铜溶液的物质的量浓度为____。
(3)若A中KCl溶液的体积也是200mL(KCl足量,不考虑氯气的溶解),电解后溶液的c(OH-) =____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用零价铁(Fe)去除水体中的硝酸盐(NO3-)已成为环境修复研究的热点之一。
(1)Fe还原水体中NO3-的反应原理如图所示。
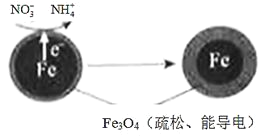
①作负极的物质是_________。
②正极的电极反应式是_________。
(2)将足量铁粉投入水体中,经24小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 接近100% | <50% |
24小时pH | 接近中性 | 接近中性 |
铁的最终物质形态 |
|
|
pH=4.5时,NO3-的去除率低。其原因是_________。
(3)其他条件与(2)相同,经1小时测定NO3-的去除率和pH,结果如下:
初始pH | pH=2.5 | pH=4.5 |
NO3-的去除率 | 约10% | 约3% |
1小时pH | 接近中性 | 接近中性 |
与(2)中数据对比,解释(2)中初始pH不同时,NO3-去除率和铁的最终物质形态不同的原因:_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com