
【题目】室温下,用0.1000mol/L盐酸分别滴定20.00mL浓度均为0.1000mol/L氢氧化钠溶液和氨水,滴定过程中溶液pH随加入盐酸体积V[HCl(aq)]的变化关系如图所示。下列说法正确的是

A. Ⅰ表示是滴定氨水的曲线,V[HCl(aq)]=20mL时:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
B. pH=7时,两种溶液中:c(Na+)=c(NH4+)
C. 滴定氢氧化钠溶液,V[HCl(aq)]>20mL时可能有c(Cl-)>c(Na+)>c(H+)>c(OH-)
D. 消定氨水时,当V[HCl(aq)]=10mL时,有2[c(OH-)-c(H+)]=c(NH4+)-c(NH3·H2O)
【答案】B
【解析】A、0.1000mol/L氢氧化钠溶液pH=13,氨水部分电离溶液pH<13,A错误。B、根据溶液中离子电荷守恒,当溶液pH=7时,HCl与NaOH混合溶液中c(Na+)+c(H+)=c(Cl -)+c(OH-),则c(Na+)=c(Cl -);HCl与氨水混合溶液中c(NH4+)+c(H+)=c(Cl -)+c(OH-),则c(NH4+)=c(Cl -),所以两种溶液中c(Na+)=c(NH4+),B正确。C、滴定NaOH溶液盐酸消耗20mL时,溶液中恰好生成NaCl,此时溶液中c(Na+)= c(Cl -)> c(H+)=c(OH-),所以当V[HCl(aq)]>20mL时,溶液中c(Cl-)>c(Na+)>c(H+)>c(OH-),当盐酸足够多时,c(Cl-)> >c(H+) c(Na+)>c(OH-),C正确。D、滴定氨水中的盐酸为10mL时,溶液中溶质为NH3H2O和NH4Cl且物质的量之比为1:1,则根据溶液中离子电荷守恒得c(NH4+)+c(H+)=c(Cl -)+c(OH-),Cl元素与N元素原子数之比为1:2,既2c(Cl -)=c(NH4+)+c(NH3H2O),约去Cl-得2[c(OH-)-c(H+)]=c(NH4+)-c(NH3·H2O),D 正确。正确答案B。


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:
【题目】金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)Ti基态原子的价层电子排布图为_______________________。
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。电负性:C________(填“>”或“<”,下同)B;第一电离能:N________O,原因是____________________________________。
(3)月球岩石——玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。SO42-的空间构型为_________形,其中硫原子采用_________杂化,写出SO42-的一种等电子体的化学式:____________________________。
(4)Ti的氧化物和CaO相互作用能形成钛酸盐CaTiO3,CaTiO3的晶体结构如图1所示(Ti4+位于立方体的顶点)。该晶体中,Ti4+和周围________个O2-相紧邻。

(5)铁晶胞的结构如图2所示,如果晶胞边长为a,铁原子半径为r,则该晶体中铁原子的空间利用率为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知![]() (x)、
(x)、![]() (y)、
(y)、![]() (z) 互为同分异构体,下列说法不正确的是( )
(z) 互为同分异构体,下列说法不正确的是( )
A. Z的二氯代物只有三种
B. x、y、z中只有x的所有原了可能处于同一平面
C. x、y可使溴的四氯化碳溶液因发生加成反应而褪色
D. x的同分异构体只有y和z两种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据A~E几种烃分子的示意图填空。

(1)B中所含官能团名称是____________。
(2)E的分子式是________________。
(3)属于同一物质的是_____________(填序号)。
(4)上述分子中属于C的同系物的是__________(填序号)。
(5)等物质的量的上述烃,完全燃烧时消耗O2最多的是____,等质量的上述烃完全燃烧时消耗O2最多的是_________(填序号)。
(6)在120℃,1.01×105Pa下,A和C分别与足量O2混合点燃,完全燃烧后气体体积没有变化的是______ (填序号)。
(7)分子式C8H18的烃,其一氯代物只有一种,该烃的名称为_____________________(用系统命名法命名)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A.依据氧化还原反应:2Ag+(aq) + Cu(s) = Cu2+(aq) + 2Ag(s)设计的原电池如图所示。

请回答下列问题:
(1)电极X的材料是____________,电解质溶液是_____________。
(2)Y电极发生的电极反应为______________________________。
(3)若开始时X、Y为质量相等的电极,当两极质量差为14克时,转移的电子数为_______。
B.燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内部的新型发电装置,是一种具有应用前景的绿色电源。下图为碱性甲烷燃料电池原理示意图:

总反应:CH4 + 2O2+ 2OH-=CO2-3 + 3H2O
正极:4H2O + 2O2 + 8e- = 8OH-
按照此图的提示回答下列问题:
(1)该燃料电池的负极是______(填“a”或“b”),b电极发生_______反应(填氧化或还原)。
(2)在正极附近溶液的碱性________(填“增强”或“减弱”)。
(3)a电极的电极方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在厨房里对水进行下列操作,能促进水的电离的是( )
A. 加入少量酒精 B. 加入少量食醋
C. 把水放入冰箱中使其降温至1℃ D. 把水加热至沸腾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铬和氢气在工业上都有重要的用途.已知:铬能与稀硫酸反应,生成氢气和硫酸亚铬(CrSO4). 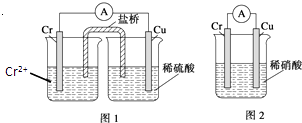
(1)铜铬构成原电池如图1,其中盛稀硫酸烧杯中的现象为: . 盐桥中装的是饱和KCl琼脂溶液,下列关于此电池的说法正确的是: A.盐桥的作用是使整个装置构成通路、保持溶液呈电中性,凡是有盐桥的原电池,盐桥中均可以用饱和KCl琼脂溶液
B.理论上1molCr溶解,盐桥中将有2molCl﹣进入左池,2molK+进入右池
C.此过程中H+得电子,发生氧化反应
D.电子从铬极通过导线到铜极,又通过盐桥到转移到左烧杯中
(2)如构成图2电池发现,铜电极上不再有图1的现象,铬电极上产生大量气泡,遇空气呈红棕色.写出正极电极反应式: .
(3)某同学把已去掉氧化膜的铬片直接投入氯化铜溶液时,观察到了预料之外的现象:①铬片表面上的铜没有紧密吸附在铬片的表面而是呈蓬松的海绵状;②反应一段时间后有大量气泡逸出,且在一段时间内气泡越来越快,经点燃能发出爆鸣声,证明是氢气.请解释这两种现象的原因 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某条件下,合成氨反应的数据如下:N2(g)+3H2(g)2ΝΗ3(γ)
起始浓度/molL﹣1 | 1.0 | 3.0 | 0.2 |
2s末浓度/molL﹣1 | 0.6 | 1.8 | 1.0 |
4s末浓度/molL﹣1 | 0.4 | 1.2 | 1.4 |
当用氨气浓度的增加来表示该反应的速率时,下列说法中错误的是( )
A.2s末氨气的反应速率=0.4mol(Ls)﹣1
B.前2s时间内氨气的平均反应速率=0.4mol(Ls)﹣1
C.前4s时间内氨气的平均反应速率=0.3mol(Ls)﹣1
D.2~4s时间内氨气的平均反应速率=0.2mol(Ls)﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com