
| A. | 该溶液的pH=4 | |
| B. | 升高温度,溶液的pH增大 | |
| C. | 此酸的电离平衡常数约为1×10-7 | |
| D. | 若要使HA的电离平衡向左移动且溶液的pH值减小,可以在溶液中通入HCl气体 |
分析 A.利用氢离子的浓度计算pH;
B.温度升高促进电离,氢离子浓度越大,pH越小;
C.根据电离度及离子的浓度计算电离平衡常数;
D.向溶液中加氢离子,抑制弱酸的电离.
解答 解:A.HA电离出的c(H+)为0.1mol/L×0.1%=10-4mol/L,则pH=-lg(10-4)=4,故A正确;
B.温度升高促进弱酸的电离,氢离子浓度变大,则pH变小,故B错误;
C.由HA?H++A-,c(H+)=c(A-)=10-4mol/L,则电离平衡常数为$\frac{1{0}^{-4}×1{0}^{-4}}{0.1}$=1×10-7,故C正确;
D.向溶液中加氢离子,抑制弱酸的电离,溶液中氢离子浓度增大,所以要使HA的电离平衡向左移动且溶液的pH值减小,可以在溶液中通入HCl气体,故D正确;
故选B.
点评 本题考查弱酸的电离,明确离子的浓度、温度对电离平衡的影响及离子积的计算即可解答,难度不大,侧重于考查学生的分析能力.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:选择题
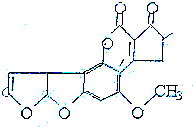 黄曲霉素AFTB(见图)是污染粮食的真菌霉素,人类的特殊基因在黄曲霉素作用下会发生突变,并有引发肝癌的可能性.关于黄曲霉素的说法正确的是( )
黄曲霉素AFTB(见图)是污染粮食的真菌霉素,人类的特殊基因在黄曲霉素作用下会发生突变,并有引发肝癌的可能性.关于黄曲霉素的说法正确的是( )| A. | 该化合物的分子式为C16H12O6 | |
| B. | 该化合物水解可生成醇类化合物 | |
| C. | 跟1mol该化合物反应的H2和NaOH的最大值分别是6mol和2mol | |
| D. | 该化合物所有原子可能在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mL浓氨水加水稀释至l00mL后,溶液中n(OH-)减少 | |
| B. | 室温时,0.1 mol•L-1某一元酸HA在水中有0.1%发生电离,则该溶液的pH=4 | |
| C. | 25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA | |
| D. | 向Na2CO3溶液通入CO2,可使水解平衡:CO32-+H2O?HCO3-+OH-向正反应方向移动,则溶液pH增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水氨水食盐水都能导电,所以Cl2、NH3和氯化钠都是电解质 | |
| B. | 向醋酸溶液中加入少量醋酸溶液,原醋酸电离平衡一定向正向移动 | |
| C. | 升高温度能促进弱电解质的电离 | |
| D. | 强电解质溶液的导电能力一定比弱电解质溶液的导电能力强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯分子中均含有碳碳双键,二者都能发生加成反应 | |
| B. | 汽油、煤油、植物油均为含碳、氢、氧三种元素的化合物 | |
| C. | 苯、乙醇和乙酸都能发生取代反应 | |
| D. | 羊毛、蚕丝和棉花等天然高分子材料的主要成分都是蛋白质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com