
向10 mL 0.1 mol·L-1NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液xmL,下列叙述正确的是( )
A.x=10时,溶液中有N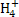 、Al
、Al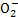 、S
、S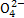 ,且c(N
,且c(N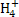 )>c(S
)>c(S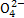 )
)
B.x=10时,溶液中有N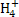 、Al3+、S
、Al3+、S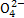 ,且c(N
,且c(N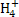 )>c(Al3+)
)>c(Al3+)
C.x=30时,溶液中有Ba2+、Al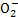 、OH-,且c(OH-)<c(Al
、OH-,且c(OH-)<c(Al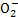 )
)
D.x=30时,溶液中有Ba2+、Al3+、Al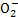 ,且c(OH-)=c(Ba2+)
,且c(OH-)=c(Ba2+)
科目:高中化学 来源: 题型:
在一定温度下,向一个2 L的真空密闭容器中事先装入催化剂,通入1 mol N2和3 mol H2,经过一段时间后,测得容器内压强为反应起始的0.9倍,在此时间内以H2表示的平均速率为0.1 mol·L-1·min-1,则所经过的时间是( )
A.5 min B.4 min C.3 min D.2 min
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组的同学在获得了如下资料的情况下,利用下面的装置来探究二氧化氮与碳酸氢钠溶液反应的产物及反应的机理。
资料:①亚硝酸是一种弱酸,酸性较碳酸酸性强;
②亚硝酸不稳定,很易分解:3HNO2===HNO3+2NO↑+H2O。
实验步骤如下:
①检查装置气密性;
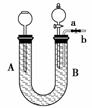
②在U形管中盛满蒸馏水,从b处通入二氧化氮气体,在U形管的B处得到无色气体,打开分液漏斗活塞,使少量气体进入分液漏斗,在分液漏斗中看到有红棕色气体;
③在U形管中盛满饱和碳酸氢钠溶液,从b处通入二氧化氮气体,在U形管的B处也得到无色气体,打开分液漏斗活塞,使少量气体进入分液漏斗,在分液漏斗中却看不到红棕色气体;
④将③中B处无色气体通过导管b通入足量澄清石灰水中有白色沉淀生成;
⑤将U形管中盛满氢氧化钠溶液,从b处通入二氧化氮时在B处得不到任何气体。
请回答下列各题:
(1)检查装置气密性的方法为__________________________________________________。
(2)在②中B处得到的无色气体是__________;用两个化学方程式表示二氧化氮与水反应的化学反应机理:_________________________________________________________________。
(3)在③中B处得到的无色气体(单一纯净)是________;只得到该无色气体的原因是________________________________________________________________________。
(4)取出③中得到的溶液,加入足量稀盐酸,预测可观察到的现象________________________________________________________________________。
(5)写出⑤中发生反应的化学方程式__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
反应A(g)+3B(g) 2C(g)+2D(g)在四种不同情况下的反应速率分别为
2C(g)+2D(g)在四种不同情况下的反应速率分别为
①v(A)=0.15 mol·L-1·s-1
②v(B)=0.6 mol·L-1·s-1
③v(C)=0.4 mol·L-1·s-1
④v(D)=0.45 mol·L-1·s-1,
则该反应进行的快慢顺序为( )
A.④>③=②>① B.①>③=②>④
C.④>③>①>②  D.④>③
D.④>③ >②>①
>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
化学与科学、技术、社会、环境密切相关。下列有关说法中不正确的是( )
A.煤经过气化和液化两个物理变化,可变为清洁能源
B.服用铬含量超标的药用胶囊会对人体健康造成危害
C.以NO和NO2为主的氮氧化物是形成光化学烟雾和酸雨的一个重要原因
D.高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路”
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E是中学常见的5种化合物,A、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如图所示。

(1)X的单质与A反应的化学方程式是 。
(2)若试剂1是NaOH溶液,X的单质与试剂1反应的离子方程式是 。
(3)若试剂1和试剂2均是稀硫酸。
①检验物质D的溶液中金属离子的方法是 。
②将物质C溶于水,其溶液呈酸性,原因是(用离子方程式表示) 。
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
取6根铁钉,6支干净的试管及其他材料,如图所示。
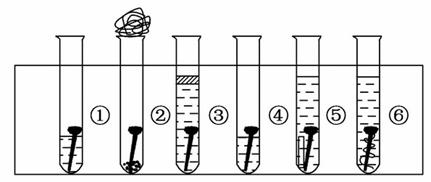
试管①放入一根铁钉,再注入蒸馏水,使铁钉和空气及水接触;
试管②在试管底部放入硅胶(是一种干燥剂),再放入铁钉,用棉花团堵住试管口,使铁钉和干燥空气接触;
试管③先放入一根铁钉,趁热倒入煮沸的蒸馏水(已 赶出原先溶解在蒸馏水中的空气)浸没铁钉,再加上一层植物油,使铁钉不能跟空气接触;
赶出原先溶解在蒸馏水中的空气)浸没铁钉,再加上一层植物油,使铁钉不能跟空气接触;
试管④中放入铁钉注入食盐水,使铁钉和空气及食盐水接触;
试管⑤放入相连的铁钉和锌片,注入自来水,浸没铁钉和锌片;
试管⑥放入相连的铁钉和铜丝,注入自来水,浸没铁钉和铜丝。
把6支试管放在试管架上,几天后观察铁钉被腐蚀的情况。
(1)上述实验中铁钉发生了电化学腐蚀的是__________ (填试管序号);在电化学腐蚀中,负极反应是_______________,正极反应是___________________。
(2)从铁钉被腐蚀的情况可知引起和促进铁钉被腐蚀的条件是_____________。
(3)为防止铁的锈蚀,工业上普遍采用的方法是________________________ _
_
(答两种方法)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验、现象与结论不一致的是( )
| 选项 | A | B | C | D |
| 实验 |
|
|
|
|
| 现象 | 出现白色沉淀 | 甲、乙中溶液均未变红 | 苯中不褪色,甲苯中褪色 | 溶液褪色 |
| 结论 | 原溶液可能含Ag+或SiO | 氯水可能氧化SCN- | 甲苯中甲基易被氧化 | 可证明分子中含碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:
碱式碳酸铜[Cu2(OH)2CO3]是一种用途广泛的化工原料,实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
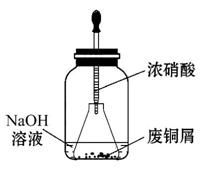
步骤一:废铜屑制硝酸铜
如图,用胶头滴管吸取浓硝酸缓慢加到锥形瓶内的废铜屑中(废铜屑过量),充分反应后过滤,得到硝酸铜溶液。
步骤二:碱式碳酸铜的制备
向大试管中加入碳酸钠溶液和硝酸铜溶液,水浴加热至70℃左右,用0.4 mol·L-1的NaOH溶液调节pH至8.5,振荡,静置,过滤,用热水洗涤,烘干,得到碱式碳酸铜产品。
完成下列填空:
(1)写出浓硝酸与铜反应的离子方程式_________________________________。
(2)上图装置中NaOH溶液的作用是____________________________________。
(3)步骤二中,水浴加热所需仪器有____________、____________(加热、夹持仪器、石棉网除外),水浴加热的优点是_________________________________。
(4)若实验得到2.42 g样品(只含CuO杂质),取此样品加热至分解完全后,得到1.80 g固体,此样品中碱式碳酸铜的质量分数是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com