
【题目】如图是用铁铆钉固定两个铜质零件的示意图,若该零件置于潮湿空气中,下列说法正确的是
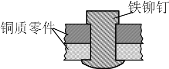
A.发生电化学腐蚀,铜为负极,铜极产生H2
B.铜易被腐蚀,铜极上发生还原反应,吸收O2
C.铁易被腐蚀,铁发生氧化反应,Fe-2e-=Fe2+
D.发生化学腐蚀:Fe + Cu2+ = Cu + Fe2+
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知热化学方程式:SO2(g)+![]() O2(g)
O2(g)![]() SO3(g) ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为( )
SO3(g) ΔH=-98.32 kJ/mol,在容器中充入2 mol SO2和1 mol O2充分反应,最终放出的热量为( )
A.196.64 kJB.196.64 kJ/molC.<196.64 kJD.>196.64 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组的同学对氯气与铁的反应及产物进行了如下探究:
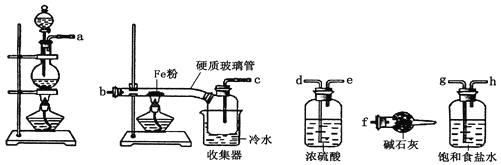
(1) 装置的连接顺序为a→_____→____→____→____→b→c→f。
(2) 硬质玻璃管中可观察到的现象是___________________;硬质玻璃管与收集器之间没有用导管连接,原因是____________________;反应一段时间、熄灭酒精灯,冷却后,将收集器及硬质玻璃管中物质快速转移至锥形瓶中,加入过量的稀盐酸和少许植物油(反应过程中不振荡),充分反应后,进行如下实验:

(3) 试剂X的化学式为___________;有同学分析淡黄色溶液中含有Fe2+,你认为_______(填“合理”或“不合理”);固体产物的成分可能为__________(填相应的字母);
A Fe和FeCl3 B FeCl2和FeCl3 C Fe、FeCl2和FeCl3 D Fe和FeCl2
(4) 加入少许植物油的作用是___________________,用离子方程式表示加入新制氯水后溶液红色加深的原因_______________________________。
(5) 某小组同学实验时在加入新制氯水后,并未得到深红色溶液,请帮助他们分析原因________,请设计实验对你所分析的原因进行验证,简要写出实验方案___________
(6)Cl2是一种黄绿色有刺激性气味的气体,实验室通常用NaOH溶液来吸收Cl2,以减少环境污染。若实验时需要450mL 4mol/L的NaOH溶液,则配制时,需要用托盘天平称取NaOH的质量为_______g,所使用的仪器除托盘天平、胶头滴管、玻璃棒外,还必须有_________。配制该溶液时,下列操作会使溶液浓度偏高的是___________。(填字母)
A 称量固体时动作缓慢 B 容量瓶未干燥立即用来配制溶液
C NaOH固体溶解后立刻转移 D 在容量瓶中定容时俯视容量瓶刻度线
E 定容后摇匀,发现液面降低,又补加少量水,重新达到刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】黑火药是我国古代四大发明之一,它的爆炸反应为:2KNO3+3C+S![]() K2S+N2↑+3CO2↑
K2S+N2↑+3CO2↑
完成下列填空:
(1)上述反应中的还原剂为___,还原产物有___,当有1molKNO3参加反应时,转移电子的数目为___。
(2)KNO3晶体类型是___,其晶体中存在的化学键有___。
(3)硫原子的核外电子排布式为___,原子核外有___种不同能量的电子。将SO2和Cl2分别通入品红溶液中,产生的现象是___;若将SO2和Cl2等体积混合后再缓缓通入品红溶液,发现品红溶液___,其原因是___。
(4)S、C和N三种元素的原子半径从小到大的顺序是___;K2S溶液中除OH-外其它各离子物质的量浓度的大小顺序为___。
(5)下列事实能说明碳与硫两元素非金属性相对强弱的有___。
a.同温同浓度溶液pH:Na2CO3>Na2SO4
b.酸性:H2SO3>H2CO3
c.CS2中碳元素为+4价,硫元素为-2价
d.分解温度:CH4>H2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 代表阿伏加德罗常数的数值,下列说法正确的是
A. 2.4 g 金属镁变成镁离子时失去的电子数目为 0.1NA
B. 18 g 水中含有 0.1NA 个水分子
C. 22.4 L 氮气所含的电子数目为 NA
D. 17 g 氨气所含电子数目为 10NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜冶金术以火法治为主,炼铜的副产品SO2多用于制硫酸和石背等化学产品。火法炼铜的工艺流程如下:

反应I:2Cu2S(s)+3O2(g)→2Cu2O(s)+2SO2(g)+768.2kJ
反应II:2Cu2O(s)+Cu2S(s)→6Cu(s)+SO2(g)-116.0kJ
(1)在反应Ⅱ中,每生成1mol SO2转移电子_______mol,反应Cu2S(s)+O2(g)→2Cu(s)+SO2(g)+Q的Q=_____kJ。
(2)理论上m1:m2=_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用乙酸和正丁醇制备乙酸正丁酯,有关物质的相关数据如下:
化合物 | 密度/gcm-3 | 沸点/℃ | 溶解度/100g水 |
正丁醇 | 0.810 | 118.0 | 9 |
冰醋酸 | 1.049 | 118.1 | 互溶 |
乙酸正丁酯 | 0.882 | 126.1 | 0.7 |
I.乙酸正丁酯粗产品的制备
在干燥的A中,装入沸石,加入11.5mL正丁醇和9.4mL冰酷酸,再加3~4滴浓硫酸,然后安装分水器(作用:实验过程中不断分离除去反应生成的水)。温度计及回流冷凝管,热冷凝回流反应。
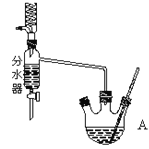
(1)实验过程中可能产生多种有机副产物。写出其中两种的结构简式:_________。
(2)实验中为了提高乙酸正丁酯的产率,采取的措施是:_________。
II.乙酸正丁酯粗产品的制备
(3)将乙酸正丁酯粗产品用如下的操作进行精制:①水洗,②蒸馏,③用无水MgSO4干燥,④用10%碳酸钠洗涤,正确的操作步骤是_________。
a ①②③④ b ③①④② c ①④①③② d ④①③②③
(4)将酯层采用下图所示装置蒸馏,图中仪器B的名称___________。冷却水从______口进入(填字母),蒸馏收集乙酸正丁酯产品时,应将温度控制在_________左右。
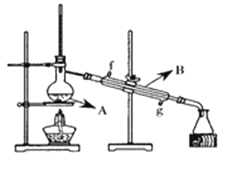
III.计算产率
(5)测量分水器内由乙酸与正丁醇反应生成的水体积为1.8mL,假设在制取乙酸正丁酯过程中反应物和生成物没有损失,且忽略副反应,计算乙酸正丁酯的产率______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下发生反应 2SO3(g)![]() 2SO2(g)+O2(g),将2 mol SO3通入2 L容积恒定的密闭容器中,若维持容器内温度不变,5 min末测得SO3的物质的量为0.8 mol。则下列说法正确的是
2SO2(g)+O2(g),将2 mol SO3通入2 L容积恒定的密闭容器中,若维持容器内温度不变,5 min末测得SO3的物质的量为0.8 mol。则下列说法正确的是
A.若某时刻消耗了1 molSO3同时生成了0.5molO2,则表明该反应达到了平衡状态
B.若起始时充入3 mol SO3,起始时SO3分解速率不变
C.0~5min,SO2的生成速率v(SO2)=0.12mol·L-1·min-1
D.达到平衡时,SO2和SO3的浓度相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com