
分析 (1)依据题干:计算出样品中变质NaOH的质量可知实验目的;
(2)已知20℃时,Na2CO3溶解度为21.7g,NaOH溶解度为108.3g,所以依据碳酸钠的溶解度计算需要水的质量;溶解固体需要的仪器:烧杯、玻璃杯、量筒;
(3)根据盐酸与碳酸钠反应的化学方程式和生成的二氧化碳的质量,列出比例式,就可计算出该样品中Na2CO3的质量,进而计算氢氧化钠的质量和变质程度;
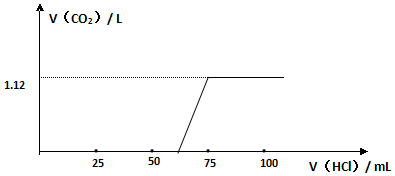
(4)依据图象可知,NaOH被盐酸中和后继续滴加盐酸未立即产生气体,可知碳酸根离子与盐酸反应,先生成碳酸氢根离子,碳酸氢根离子再与盐酸反应生成二氧化碳,据此分析.
解答 解:(1)依据题干可知,实验目的为:测定NaOH的变质程度;
故答案为:测定NaOH的变质程度;
(2)已知20℃时,Na2CO3溶解度为21.7g,NaOH溶解度为108.3g?
若要将所称取的样品恰好溶解,设最多需要蒸馏水mg,则:21.7:100=13.3:m,解得m=61.3g;溶解固体需要的仪器:烧杯、玻璃杯、量筒;
故答案为:61.3; 烧杯?玻璃棒?量筒;
(3)设该样品中Na2CO3的质量是x,
2HCl+Na2CO3=2NaCl+H2O+CO2↑
106 44
x 2.2g
∴106:44=x:2.2g,
解之得:x=5.3g.
故答案为:5.3g;
NaOH的质量=13.3g-5.3g=8g,
则由碳酸钠的质量为5.3g,设反应的氢氧化钠的质量为z
2NaOH+CO2═Na2CO3+H2O
80 106
z 5.3g
$\frac{80}{z}$=$\frac{106}{5.3}$,解:z=4g,变质程度为:$\frac{4g}{13.3-5.3+4}$×100%=33.3%;
氢氧化钠物质的量为:$\frac{8g}{40g/mol}$=0.2mol,依据HCl~NaOH,可知消耗盐酸的物质的量为:0.2mol,与NaOH反应消耗的盐酸体积为:$\frac{0.2mol}{4mol/L}$=0.05L,即50mL;
故答案为:8.00g; 33.3%; 50.0;
(4)依据图象可知,NaOH被盐酸中和后继续滴加盐酸未立即产生气体,可知碳酸根离子与盐酸反应,先生成碳酸氢根离子,碳酸氢根离子再与盐酸反应生成二氧化碳,得出结论:碳酸根离子与盐酸的反应是分步进行的;
故答案为:NaOH被盐酸中和后继续滴加盐酸未立即产生气体;碳酸根离子与盐酸的反应是分步进行的.
点评 本题难度较大,主要考查了通过图象分析有价值的数据,然后根据化学方程式进行有关量的计算,培养学生的分析能力和解决问题的能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | pH均为2的醋酸和盐酸加水稀释100倍,所得溶液的pH:醋酸>盐酸 | |
| B. | pH为11的氨水和pH为3的盐酸溶液等体积混合,所得溶液中c(Cl-)>c(NH4+)>c(OH-)>c(H+) | |
| C. | 浓度均为0.1 mol/L的NaOH溶液和CH3COONa溶液等体积混合后的溶液:c(Na+)+c(CH3COO-)=c(OH-)+c(H+) | |
| D. | 浓度均为0.1mol/L的醋酸和CH3COONa溶液等体积混合,溶液中有下列关系:c(CH3COOH)+2c(H+)=c(CH3COO-)+2c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若将四种溶液稀释100倍,稀释后溶液pH大小顺序:③>④>②>① | |
| B. | 等体积的③和④分别用等浓度的硫酸溶液中和,消耗硫酸溶液的体积:③>④ | |
| C. | 等体积的②和③混合生成强酸弱碱盐,混合后溶液呈酸性 | |
| D. | 等体积的①和②分别与足量的锌粒反应生成的氢气在同温同压下体积:①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消耗硫酸亚铁铵的物质的量为n(2-x)mol | |
| B. | 处理废水中Cr2O72- 的物质的量为nxmol | |
| C. | 反应中发生转移的电子数为3n mol | |
| D. | 在FeO•FeyCrxO3中3x=y |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
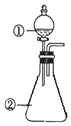 用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是( )| 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
| B | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
| D | 亚硫酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com