
| A、0.8mol/L |
| B、1.2mol/L |
| C、1.6mol/L |
| D、2.0mol/L |
| n |
| V |
| 0.8mol |
| 0.5L |


科目:高中化学 来源: 题型:


| 醇 |
| 浓H2SO4/△④ |
| 催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、有紫黑色固体析出 |
| B、形成均匀的紫红色溶液 |
| C、液体分层,下层紫红色 |
| D、液体分层,上层紫红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:| 实验编号 | 温度/℃ | 试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
| 0.6 mol/L H 2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | |||
| 1 | 20 | 3.0 | 2.0 | 3.0 | 2.0 | 4.0 |
| 2 | 20 | 3.0 | m | 2.5 | n | 4.8 |
| 3 | 20 | 3.0 | 3.0 | 2.0 | 2.0 | t1 |
| 4 | 30 | 3.0 | 2.0 | 3.0 | 2.0 | t2 |
| 实验编号 | 温度/℃ | 试管中所加试剂及其用量/mL | 再向试管中加入少量固体 | 溶液褪至无色所需时间/min | |||
| 0.6 mol/L H 2C2O4溶液 | H2O | 0.2 mol/L KMnO4溶液 | 3 mol/L 稀硫酸 | ||||
| 5 | 20 | 3.0 | 2.0 | 3.0 | 2.0 | t3 | |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸发操作时,当出现大量晶体是,才能停止加热,用余热加热 |
| B、蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 |
| C、分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 |
| D、萃取操作时,应选择有机萃取剂,萃取剂的密度应比水大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
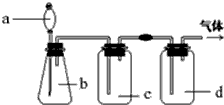
| 气体 | a | b | c | d | |
| A | SO2 | Na2SO3粉末 | 硫酸 | 浓硫酸 | NaOH溶液 |
| B | HCl | 浓盐酸 | 浓硫酸 | 浓硫酸 | 盐酸 |
| C | NH3 | 浓氨水 | 消石灰 | 浓硫酸 | 水 |
| D | Cl2 | 浓盐酸 | MnO2 | 饱和氯化钠溶液 | 浓H2SO4 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3:11 | B、11:3 |
| C、1:4 | D、4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电解精炼铜时,以粗铜作阴极,纯铜作阳极 |
| B、金属氧化物均为碱性氧化物 |
| C、Na2O2与水发生反应时,Na2O2作氧化剂,水作还原剂 |
| D、自行车钢架生锈主要是电化学腐蚀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com