
���� ��1������n=$\frac{V}{{V}_{m}}$����HCl���ʵ���������m=nM����HCl����������m=��V����ˮ������������������Һ��������������c=$\frac{1000�Ѧ�}{M}$������Һ���ʵ���Ũ�ȣ�
��2������ϡ�Ͷ���c��Ũ��•V��Ũ��=c��ϡ��•V��ϡ�����㣻
��3��������Ӧ�������кͺ����Һ��������ù���ΪNaCl������ClԪ���غ㣺n��NaCl��=n��HCl�����ٸ���m=nM���㣮
��� �⣺��1��n��HCl��=$\frac{224L}{22.4L/mol}$=10mol��m��HCl��=10mol��36.5g•mol-1=365g��
635mLˮ������Ϊ635mL��1g/mL=635g��
�������������w=$\frac{365g}{365g+635g}$��100%=36.5%��
c��HCl��=$\frac{1000�Ѧ�}{M}$=$\frac{1000��1.18��36.5%}{36.5}$mol/L=11.8mol/L��
�������������������Ϊ36.5%�����ʵ���Ũ����11.8mol/L��
��2������c��Ũ��•V��Ũ��=c��ϡ��•V��ϡ��
��֪��c��ϡ��=11.8mol•L-1��0.1L��1.18L=1mol•L-1��
������ϡ��������ʵ���Ũ��1mol•L-1��
��3��������Ӧ�������кͺ����Һ��������ù���ΪNaCl������ClԪ���غ㣺n��NaCl��=n��HCl��=0.050L��2mol•L-1=0.1mol����m��NaCl��=0.1mol��58.5g•mol-1=5.85g��
�����յõ�����5.85�ˣ�
���� ���⿼�����ʵ���Ũ�ȼ��㡢��ѧ����ʽ���йؼ��㣬ע��Թ�ʽ�����������Ӧ�ã������������ʵ���Ũ������������֮��Ĺ�ϵ���ѶȲ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na��ϡ���ᷴӦ�����ӷ���ʽΪ2Na+2H+�T2 Na++H2�� | |
| B�� | Na2O2����ˮ����O2��2Na2O2+2H2O=4Na++4OH-+O2�� | |
| C�� | ̼�������Һ�еμ�����������Һ��Ca2+ǡ����ȫ���� Ca2++HCO3-+OH-=CaCO3��+H2O | |
| D�� | ����̼������Һ��ͨ�����������̼���壬��Һ�����CO32-+CO2+H2O=HCO3- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
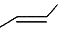 ���л���X�ļ���ʽΪ
���л���X�ļ���ʽΪ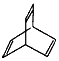
 ��
���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 5.26% | B�� | -5.26% | C�� | 5% | D�� | -5% |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| ���� | ���� | ���� | ������Ӧѡ�õ��Լ���������� |
| �� | KNO3 | KOH | ����FeCl3��Һ�������� |
| �� | FeSO4 | CuSO4 | �����������ۺ���� |
| �� | O2 | CO2 | ����ͨ��ʢ��Ũ�����NaOH��Һ��ϴ��ƿ |
| �� | CaO | CaCO3 | ����ϡ���ᣬ������ |
| A�� | �٢� | B�� | �� | C�� | �ڢ� | D�� | �ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
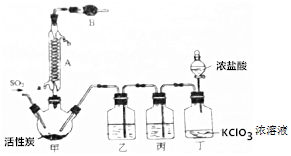
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 �û���Ӧ��ͨʽ������ͼ��ʾ�����ʼס��Һͻ�����A��BΪ��ѧ�������ʣ���ش��������⣺
�û���Ӧ��ͨʽ������ͼ��ʾ�����ʼס��Һͻ�����A��BΪ��ѧ�������ʣ���ش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com