
主族元素A和B可组成为AB2的离子化合物,则A、B两原子的最外层电子排布式分别为( )
A.ns2np2和ns2np4 B. ns1和ns2np4
C.ns2和ns2np5 D.ns1和ns2
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
下列各组离子在溶液中能够大量共存的是( )
A.NH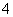 、NO
、NO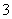 、Na+、SO
、Na+、SO
B.H+、Fe2+、Na+、NO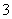
C.Ba2+、K+、Al3+、HCO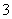
D.NH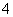 、Li+、OH-、SO
、Li+、OH-、SO
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验所对应的离子方程式正确的是( )
A.向NaAlO2溶液中通入少量CO2:AlO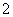 +CO2+2H2O===Al(OH)3↓+HCO
+CO2+2H2O===Al(OH)3↓+HCO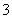
B.向沸水中滴加饱和的氯化铁溶液:Fe3++3H2O===Fe(OH)3↓+3H+
C.在碳酸氢钡溶液中加入过量的氢氧化钠溶液:Ba2++2HCO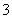 +2OH-===BaCO3↓+CO
+2OH-===BaCO3↓+CO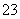 +2H2O
+2H2O
D.向FeCl2溶液中加入少量K3[Fe(CN)6]溶液:4Fe2++2[Fe(CN)6]4-===Fe4[Fe(CN)6]2↓
查看答案和解析>>
科目:高中化学 来源: 题型:
下面的排序不正确的是 ( )。
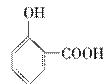
A.晶体熔点的高低: >
>
B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al
D.晶格能由大到小:NaF>NaCl>NaBr>NaI
查看答案和解析>>
科目:高中化学 来源: 题型:
金属镍及其化合物在合金材料以及催化剂等方面应用广泛。请回答下列问题:
(1)Ni原子的核外电子排布式为_____________________________;
(2)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69 pm和78 pm,则熔点NiO________FeO(填“<”或“>”);
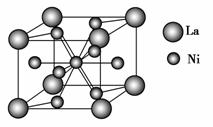
(3)NiO晶胞中Ni和O的配位数分别为________、________;
(4)金属镍与镧(La)形成的合金是一种良好的储氢材料,其晶胞结构示意图如图所示。该合金的化学式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于微粒半径的叙述中,正确的是( )
A.金属阳离子的半径大于它的原子半径
B.金属阳离子的半径小于它的原子半径
C.非金属阴离子的半径与其原子半径相等
D.非金属阴离子的半径小于其原子半径
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有相同的电子层结构,下列关系正确的是( )
A.质子数c>d
B.离子的还原性Y2->Z-
C.氢化物的稳定性H2Y>HZ
D.原子半径X<W
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是( )
A.在周期表里,主族元素所在的族序数等于原子核外电子数
B.在周期表里,元素所在的周期数等于原子核外电子层数
C.最外层电子数为8的都是稀有气体元素的原子
D.元素的原子序数越大,其原子半径也越大
查看答案和解析>>
科目:高中化学 来源: 题型:
通常把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。下面列举了一些化学键的键能数据,供计算使用。
| 化学键 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
| 键能/kJ·mol-1 | 460 | 360 | 436 | 431 | 176 | 347 |
工业上的高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)===Si(s)+4HCl(g),该反应的反应热ΔH为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com