
【题目】二甲醚是一种清洁能源,用水煤气制取甲醚的原理如下:
I.CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
II.2CH3OH(g)===CH3OCH3(g)+H2O(g)
(1)300℃和500℃时,反应I的平衡常数分别为K1、K2,且K1>K2,则其正反应为_______反应(填“吸热”或“放热”)。
(2)在恒容密闭容器中发生反应I:
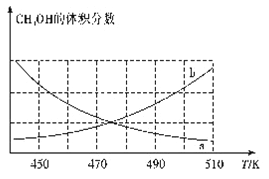
①下图能正确反映体系中甲醇体积分数随温度变化情况的曲线是______________(填“a”或“b”)。
②下列说法能表明反应已达平衡状态的是____(填标号)。
A.容器中气体的压强不再变化 B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化 D.v正(H2)=2v正(CH3OH)
(3)500K时,在2L密闭容器中充入4 mol CO和8 mol H2,4 min达到平衡,平衡时CO的转化率为80%,且2c(CH3OH)=c(CH3OCH3) ,则:
① 0~4 min,反应I的v(H2)=______,反应I的平衡常数K=______。
② 反应II中CH3OH的转化率α=_______。

(4)二甲醚燃料电池的工作原理如图听示,则X电极的电极反应式为_______。用该电池对铁制品镀铜,当铁制品质量增加64 g时,理论上消耗二甲醚的质量为_______g(精确到0.01)。
【答案】 放热 a AC 0.8mol/(L·min) 1.25(mol/L)-2 80% CH3OCH3-12e-+3H2O=2CO2↑+12H+ 7.67
【解析】(1)升高温度平衡常数减小,所以其正反应为放热反应;(2)①正反应放热,升高温度平衡向逆反应方向进行,甲醇的体积分数减小,因此下图能正确反映体系中甲醇体积分数随温度变化情况的曲线是a。②A.正反应体积减小,容器中气体的压强不再变化能表明反应已达平衡状态,A正确;B. 密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此混合气体的密度不再变化不能说明,B错误;C.混合气的平均相对分子质量是混合气的质量和混合气的总的物质的量的比值,质量不变,但物质的量是变化的,所以混合气体的平均相对分子质量不再变化可以说明,C正确;D.v正(H2)=2v正(CH3OH)均表示正反应方向,不能说明,D错误,答案选AC;(3)①4min达到平衡,平衡时CO的转化率为80%,则消耗CO是3.2mol,因此消耗氢气是6.4mol,浓度是3.2mol/L,所以0~4min,反应I的v(H2)=3.2mol/L÷4min=0.8mol/(L·min)。剩余CO是0.4mol/L,氢气是0.8mol/L,最初生成甲醇是1.6mol/L,设分解的甲醇是xmol/L,则生成二甲醚是0.5xmol/L,所以有0.5x=2×(1.6-x),解得x=1.28,所以根据方程式可知反应I的平衡常数K=![]() =1.25。②反应II中CH3OH的转化率α=1.28/1.6×100%=80%。(4)质子向Y电极移动,所以Y电极是正极,则X电极是负极,通入的是二甲醚,电极反应式为CH3OCH3-12e-+3H2O=2CO2↑+12H+。用该电池对铁制品镀铜,当铁制品质量增加64g时析出铜是1mol,转移2mol电子,则理论上消耗二甲醚的质量为
=1.25。②反应II中CH3OH的转化率α=1.28/1.6×100%=80%。(4)质子向Y电极移动,所以Y电极是正极,则X电极是负极,通入的是二甲醚,电极反应式为CH3OCH3-12e-+3H2O=2CO2↑+12H+。用该电池对铁制品镀铜,当铁制品质量增加64g时析出铜是1mol,转移2mol电子,则理论上消耗二甲醚的质量为![]() 7.67g。
7.67g。
(精确到0.01)。


科目:高中化学 来源: 题型:
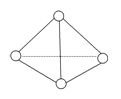
【题目】科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似。气态时,已知断裂1mol N—N键吸收167kJ热量,断裂1mol N≡N键吸收942kJ热量,则( )
A.N4与N2互称为同位素
B.N4属于一种新型的化合物
C.N4化学性质比N2稳定
D.1mol N4气体转化为N2时要放出882kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾的化合物广泛存在于自然界中。回答下列问题:
(l)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用_________形象化描述。
(2)钾的焰色反应为_____色,发生焰色反应的原因是__________________________________。
(3)叠氮化钾(KN3)晶体中,含有的共价键类型有_____________,N3-的空间构型为__________。
(4)CO能与金属K和Mn形成配合物K[Mn(CO)5],Mn元素基态原子的价电子排布式为______________。
(5)原子坐标参数可表示晶饱内部各原子的相对位置,金属钾是体心立方晶系,其构型如图。其中原子坐标参数A(0,0,0)、B(l,0,0),则C原子的坐标参数为_____________。

(6)钾晶体的晶胞参数为a pm。假定金属钾原子为等径的刚性小球且处于体对角线上的三个球相切,则钾原子的半径为____________pm,晶体钾的密度计算式是_____________g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,a、b、d均为石墨电极,c为Mg电极,通电进行电解(电解液足量),下列说法正确的是

A. 向甲中加入适量Cu(OH)2,溶液组成可以恢复
B. 电解一段时间,乙溶液中会产生白色沉淀
C. 当b极增重3.2g时,d极产生的气体体积为1.12L
D. 甲中b极上的电极反应式为:4OH--4e-=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于热化学反应的描述中正确的是( )
A. HCl和NaOH反应的中和热ΔH=-57.3 kJ·mol-1,则H2SO4和Ca(OH)2反应的反应热为ΔH=2×(-57.3)kJ·mol-1
B. CO(g)的燃烧热是283.0 kJ·mol-1,则2CO2(g)2CO(g)+O2(g) ΔH=+566 kJ·mol-1
C. 一定条件下,将0.5mol N2(g)和1.5molH2(g)置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,其热化学方程式为:N2(g)+3H2(g) ![]() 2NH3(g) △H=-38.6kJ·mol-1
2NH3(g) △H=-38.6kJ·mol-1
D. 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com