
【题目】某化学兴趣小组为探究铜跟浓硫酸的反应,用下图所示装置进行有关实验。
请回答下列问题:
(1)试管Ⅰ中发生反应的化学方程式为: 。
(2)可抽动铜丝的作用是。
(3)试管Ⅱ中现象为;可证明。
(4)试管Ⅲ的管口用浸有碱(NaOH溶液)的棉团塞住,其作用是;
【答案】
(1)Cu+2 H2SO4(浓) ![]() CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(2)可控制反应随时停止
(3)品红溶液褪色;SO2具有漂白性
(4)吸收未反应完的SO2 , 防止SO2污染环境。
【解析】(1)试管Ⅰ中铜与浓硫酸在加热条件下反应生成二氧化硫,反应的化学方程式为:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O,所以答案是:Cu+2H2SO4(浓)
CuSO4+SO2↑+2H2O,所以答案是:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+2H2O;(2)通过抽动铜丝,以随时中止反应,避免浪费原料、减少污染气体的产生,所以答案是:可控制反应随时停止;(3)二氧化硫具有漂白性,所以试管Ⅱ中品红溶液褪色,所以答案是:品红溶液褪色;SO2具有漂白性;(4)二氧化硫有毒,多余的气体不能直接排放,需要用氢氧化钠溶液吸收SO2气体,防止空气污染,反应的化学方程式为:SO2+2NaOH=Na2SO3+H2O,所以答案是:吸收未反应完的SO2 , 防止SO2污染环境。
CuSO4+SO2↑+2H2O;(2)通过抽动铜丝,以随时中止反应,避免浪费原料、减少污染气体的产生,所以答案是:可控制反应随时停止;(3)二氧化硫具有漂白性,所以试管Ⅱ中品红溶液褪色,所以答案是:品红溶液褪色;SO2具有漂白性;(4)二氧化硫有毒,多余的气体不能直接排放,需要用氢氧化钠溶液吸收SO2气体,防止空气污染,反应的化学方程式为:SO2+2NaOH=Na2SO3+H2O,所以答案是:吸收未反应完的SO2 , 防止SO2污染环境。


科目:高中化学 来源: 题型:
【题目】人们常用原子结构示意图表示原子的核外电子排布.
(1)请依次画出氧原子、镁原子的原子结构示意图:
(2)氧原子易电子(填:得或失),表现为具有较强的性(填:氧化或还原).
(3)写出氧元素与镁元素形成化合物的化学式 .
(4)仅由氧原子、镁原子的原子核外电子排布,写出一条原子核外电子运动规律: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.SO2通入酸性KMnO4溶液,褪色:2MnO4﹣+4H++5SO2═2Mn2++5SO42﹣+2H2O
B.氯化铝溶液通入过量氨水:Al3++4OH﹣=AlO2﹣+2H2O
C.NH4HSO3溶液与足量的NaOH溶液混合加热:NH4++HSO3﹣+2OH﹣ ![]() NH3?↑+SO32﹣+2H2O
NH3?↑+SO32﹣+2H2O
D.次氯酸钙溶液中通入过量二氧化碳:Ca2++2ClO﹣+H2O+CO2=CaCO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述错误的是
A.淀粉是一种天然高分子化合物
B.可以有植物油来萃取溴水中的溴单质
C.天然油脂的主要成分是高级脂肪酸甘油酯
D.工业上可以用油脂制造肥皂和油漆等化工产品
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年雾霾天气多次肆虐我国中东部地区.其中,汽车尾气和燃煤尾气是造成空气污染的原因之一. 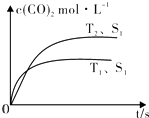
(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:
2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)△H>0.
①写出该反应的平衡常数表达式 .
②判断该反应在一定条件下,体积恒定的密闭容器中是否达到化学平衡状态的依据是 .
A.容器中密度不变 B.单位时间内消耗2molCO2 , 同时消耗1mol二甲醚
C.v(CO2):v(H2)=1:3 D.容器内压强保持不变
(2)汽车尾气净化的主要原理为:2NO(g)+2CO(g) ![]() 2CO2(g)+N2 (g)
2CO2(g)+N2 (g)
在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示.据此判断:
①该反应的△H0(选填“>”、“<”).
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率.若催化剂的表面积S1>S2 , 在图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线 .
(3)已知:CO(g)+2H2(g)CH3OH(g)△H=﹣a kJmol﹣1 .
①经测定不同温度下该反应的平衡常数如下:
温度(℃) | 250 | 300 | 350 |
K | 2.041 | 0.270 | 0.012 |
若某时刻、250℃测得该反应的反应物与生成物的浓度为c(CO)=0.4molL﹣1、c(H2)=0.4molL﹣1、c(CH3OH)=0.8molL﹣1 , 则此时v正v逆(填“>”、“<”或“=”).
②某温度下,在体积固定的2L的密闭容器中将1mol CO和2mol H2混合,测得不同时刻的反应前后压强关系如下:
时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
达到平衡时CO的转化率为 .
(4)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视.它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势.氨在燃烧实验中相关的反应有:
4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H1 ①
4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H2 ②
4NH3(g)+6NO(g)=5N2(g)+6H2O(l)△H3 ③
请写出上述三个反应中△H1、△H2、△H3三者之间关系的表达式,△H1= .
(5)美国Simons等科学家发明了使NH3直接用于燃料电池的方法,其装置为用铂作为电极,加入KOH电解质溶液中,其电池反应为 4NH3+3O2=2N2+6H2O,写出该燃料电池的正极反应式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下的HCl气体4.48L溶于水形成100ml溶液,然后与足量的铁屑充分反应.计算:
(1)所得盐酸的物质的量浓度;
(2)生成H2的体积;
(3)将生成的FeCl2配成400ml溶液,此溶液中FeCl2的物质的量浓度是多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com