
分析 根据混合气体的总体积以及各成分所占的百分含量确定各自的体积以及物质的量,根据热化学方程式的意义来计算一定物质的量的气体燃烧放出的热量.
解答 解:根据题意,各个气体的百分含量:H2 50%、CH4 30%、CO 10%,所以1M3(1000L)混合气体中,含有氢气的体积是500L,即标况下$\frac{500L}{22.4L/mol}$=$\frac{500}{22.4}$mol,含有甲烷的体积是300L,物质的量是$\frac{300}{22.4}$mol,一氧化碳的体积是100L,物质的量是$\frac{100}{22.4}$mol,根据热化学方程式系数和能量之间的正比例关系,所以该种煤气燃烧时放出的热量为:285.8kJ×$\frac{500}{22.4}$+282.6kJ×$\frac{100}{22.4}$+$\frac{300}{22.4}$×890.3kJ≈19564.73kJ,
答:燃烧1M3(标准状况)的煤气时放出的热量为19564.73kJ.
点评 本题考查热化学方程式的系数和能量之间的关系知识,注意知识的归纳和整理是解题的关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 同物质的量的浓度的三种溶液:Na2SO4、MgSO4、Al2(SO4)3,其体积比为3:2:1,则SO42-浓度之比为1:1:3 | |
| B. | 将10 mL 1 mol/L H2SO4稀释成0.1 mol/L的H2SO4,可向该溶液中加入100 mL水 | |
| C. | 将1 mol/L的NaCl溶液和0.5 mol/L的BaCl2溶液等体积混合后,不考虑溶液体积变化c(Cl-)=0.75 mol/L | |
| D. | 50 g浓度为c mol/L,密度为ρ g•cm-3的氨水(ρ<1)中加入一定量的水(ρ=1g•cm-3)稀释成0.5c mol/L,则加入水的体积应小于50 mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
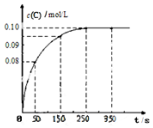 在一定温度下,向2L恒容密闭容器中充入1mol A,发生A(g)?B(g)+C(g)反应.反应过程中c(C)随时间变化的曲线如图所示,下列说法不正确的是( )
在一定温度下,向2L恒容密闭容器中充入1mol A,发生A(g)?B(g)+C(g)反应.反应过程中c(C)随时间变化的曲线如图所示,下列说法不正确的是( )| A. | 反应在 0~50 s 的平均速率=1.6×10-3mo1/(L•s) | |
| B. | 该温度下,反应的平衡常数值为0.025 | |
| C. | 反应平衡后,再向容器中充入A、B、C各1mol,此时v(正)<v(逆) | |
| D. | 保持其他条件不变,升高温度,平衡时c(B)=0.11mol/L,则该反应的△H<0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在 16g18O2中含有NA个氧原子 | |
| B. | 16gCH4中含有4NA个C-H 键 | |
| C. | 22g 某气体含分子数为 0.5NA,则其摩尔质量为 44 | |
| D. | 含 NA个Na+的Na2O溶解于1L水中,Na+的物质的量浓度为 1 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | B. | x+y<z | ||
| C. | C的体积分数降低 | D. | B的转化率提高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平均相对分子质量 | B. | SO3(g)的转化率 | ||
| C. | $\frac{c(S{O}_{3})}{c(S{O}_{2})}$ | D. | c2(SO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
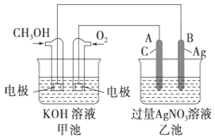 如图是一个化学过程的示意图,已知池的总反应式为2CH3OH+3O2+4KOH═2K2CO3+6H2O.
如图是一个化学过程的示意图,已知池的总反应式为2CH3OH+3O2+4KOH═2K2CO3+6H2O.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com