
| A. | -1 528.6 kJ•mol-1 | B. | +1 220 kJ•mol-1 | ||
| C. | -1220 kJ•mol-1 | D. | +1 528.6 kJ•mol-1 |
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠溶液中通入少量二氧化硫:SO2+OH-=HSO3- | |
| B. | 氢氧化铜加到盐酸中:Cu(OH)2+2H+=Cu2++2H2O | |
| C. | 盐酸滴入氨水中:H++OH-=H2O | |
| D. | 碳酸钙溶解于稀硝酸中:CO32-+2H+=CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Cl2、漂白液在生产、生活中广泛用于杀菌、消毒.回答下列问题:
Cl2、漂白液在生产、生活中广泛用于杀菌、消毒.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
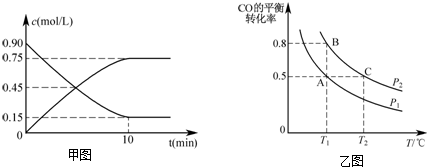
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 某化合物不是离子化合物就是共价化合物 | |
| B. | 混合物中元素一定呈化合态 | |
| C. | 金属氧化物一定是碱性氧化物 | |
| D. | 由一种元素组成的物质一定是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验目的 | 主要仪器 | 试剂 | |
| A | 测定NaOH溶液浓度 | 滴定管、锥形瓶、烧杯 | NaOH溶液、0.1000mol•L-1盐酸 |
| B | 实验室制取H2 | 试管、带导管的橡皮塞 | 锌粒、稀HNO3 |
| C | 鉴别葡萄糖和蔗糖 | 试管、烧杯、酒精灯 | 葡萄糖溶液、蔗糖溶液、银氨溶液 |
| D | 分离Br2和CCl4混合物 | 分液漏斗、烧杯 | Br2和CCl4混合物、蒸馏水 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28.4 g | B. | 28.4 mol | C. | 71 L | D. | 71 g/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com