
����Ŀ��ij�о�С��Ϊ�Ƚ�Al��Fe�Ľ�����ǿ���������ͼ1��ʾ��װ�ã�������ƿ��ʢ�ŵ���100mlϡ���ᣨ��Ӧǰ����Һ����仯���Ժ��Բ��ƣ��� 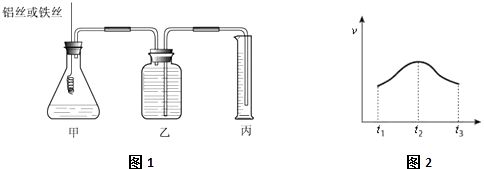
��1����Ҫ�Ƚϲ�������Ŀ��������ַ�����һ���DZȽϲ�����ͬ������������ʱ�䣬��һ���DZȽ���
��2��ʵ���ò�����������ʣ�v����ʱ�䣨t���Ĺ�ϵ��ͼ2��ʾ����t1��t2ʱ���������ӿ�˵���÷�Ӧ��������Ȼ����ȣ���Ӧ��t2��t3ʱ����������������Ҫԭ������
��3���������ͬ�����£��Ѽ���ƿ��ʢ��ϡ����ij�H+Ũ����ͬ��ϡ���ᣬ���ַ�Ӧ���ԭ�������࣬ԭ�����������д��������һ�ּ��ɣ�
���𰸡�
��1����ͬʱ���ڲ������������С
��2�����ȣ�����Ũ�Ȳ��ϼ�С
��3��Cl����ٽ��÷�Ӧ�Ľ��У�����SO42�����Ƹ÷�Ӧ�Ľ��У�
���������⣺��1����v= ![]() ֪����Ӧ����������������ʱ���йأ�����һ���ǹ̶�����Ƚ�ʱ�䣬��һ���ǹ̶�ʱ��Ƚ���������Դ��ǣ���ͬʱ���ڲ������������С����2���÷�Ӧ��һ�����ȵķ�Ӧ�����ŷ�Ӧ�Ľ��У��ų�������Խ�࣬��Һ���¶�Խ�ߣ��¶�Խ�߷�Ӧ����Խ�����ŷ�Ӧ�Ľ��У���Һ�������Ũ�Ȳ��ϼ�С��Ũ��ԽС��Ӧ����ԽС��
֪����Ӧ����������������ʱ���йأ�����һ���ǹ̶�����Ƚ�ʱ�䣬��һ���ǹ̶�ʱ��Ƚ���������Դ��ǣ���ͬʱ���ڲ������������С����2���÷�Ӧ��һ�����ȵķ�Ӧ�����ŷ�Ӧ�Ľ��У��ų�������Խ�࣬��Һ���¶�Խ�ߣ��¶�Խ�߷�Ӧ����Խ�����ŷ�Ӧ�Ľ��У���Һ�������Ũ�Ȳ��ϼ�С��Ũ��ԽС��Ӧ����ԽС��
���Դ��ǣ����ȣ�����Ũ�Ȳ��ϼ�С����3�������ϡ���������ͬ��������H+ �� ϡ����ij�H+Ũ����ͬ��ϡ���ᣬ���ַ�Ӧ���ԭ�������࣬����ΪCl����ٽ��÷�Ӧ�Ľ��У�����SO42�����Ƹ÷�Ӧ�Ľ��У���
���Դ��ǣ�Cl����ٽ��÷�Ӧ�Ľ��У�����SO42�����Ƹ÷�Ӧ�Ľ��У���
�����㾫����ͨ������������ȷ�Ӧ�ͷ��ȷ�Ӧ�����ջ�ѧ�ϰ����������Ļ�ѧ��Ӧ��Ϊ���ȷ�Ӧ����ѧ�ϰѷų������Ļ�ѧ��Ӧ��Ϊ���ȷ�Ӧ�����Խ����⣮



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ȼ�ѧ����ʽ�ó��Ľ�����ȷ����(����)
A. ���³�ѹ�£�1 g H2������Cl2��ȼ������HCl���ų�92.3 kJ�����������Ȼ�ѧ����ʽ�ɱ�ʾΪH2(g)+Cl2(g)2HCl(g)����H=+184.6 kJ��mol-1
B. ����ı�ȼ����Ϊ��H=-890.3 kJ��mol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪCH4(g)+2O2(g)CO2(g)+2H2O(g)����H=-890.3 kJ��mol-1
C. ��֪NaOH(aq)+HCl(aq)NaCl(aq)+H2O(l)����H=-57.4 kJ��mol-1����20.0 g NaOH��ϡ��Һ��ϡ������ȫ�кͣ��ų�28.7 kJ������
D. ��ͬ�����£�2 mol��ԭ�������е�����С��1 mol����������е�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����¶Ȳ���������£��ں��ݵ������н������з�Ӧ��N2O4��g���T2NO2��g������N2O4��Ũ����0.1molL��1����0.07molL��1��Ҫ15s����ôN2O4��Ũ����0.07molL��1����0.05molL��1����ķ�Ӧʱ�䣨 ��
A.����5s
B.����10s
C.��10s
D.����10s
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ɻ��Ƚ�ͨ�����ŷŵ�β���к��еĴ���CO��NO �ȴ�����Ⱦ������������������Ҫԭ���о�CO��NO ��ת�����ڻ����ĸ������ش����塣
��1���������뽫CO�����з�Ӧ��ȥ��2CO(g)=2C(s) +O2(g) ��H>0������Ϊ�������ܷ�ʵ�ֲ�˵��������__________________________��
��2���û���̿��ԭ�����Դ�������β���еĵ������ij�о�С����2 L�ĺ����ܱ������м���0.100 mL NO ��2.030 mol�������̿��������Ӧ��C(s)+2NO(g) ![]() N2(g)+CO2(g)���ڲ�ͬ�¶��²��ƽ����ϵ�и����ʵ����ʵ������±���
N2(g)+CO2(g)���ڲ�ͬ�¶��²��ƽ����ϵ�и����ʵ����ʵ������±���
T/�� | n���������̿��/mol | n(NO)/mol | n(N2)/mol | n(CO2)/mol |
200 | 2.000 | 0.040 | 0.030 | 0.030 |
350 | 2.005 | 0.050 | 0.025 | 0.025 |
���÷�Ӧ������ӦΪ___________(��������������������)��Ӧ��
��200��ʱ����Ӧ�ﵽƽ���������������ٳ���0.100 mol NO���ٴδﵽƽ��������NO�İٷֺ�����__________(��������������С������������)��
��������Ӧ��350��ʱ��ƽ�ⳣ��K=_______________��
��3�����ܱ������з�����������,�ﵽƽ��ʱ�����д�ʩ�����NOת���ʵ���___________(����ĸ)��
A.ѡ�ø���Ч�Ĵ��� B.����C(s)����
C.���ͷ�Ӧ��ϵ���¶� D.��С���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����Ƹ���������ʱ�����ܲ������շ��������� �� ��
A.����B.������̼C.��ȲD.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������仯�������������������ַ�Ӧ;����ijЩ��Ӧ�����Ͳ�����ʡ�ԡ������й�˵������ȷ���ǣ� ��

A. ;���ٵķ�Ӧ��������ŨHNO3��ǿ������
B. ;�������۵ĵڶ�����Ӧ��ʵ�������п���ͨ������O2��Ũ�����ͳɱ�
C. ��;�����������۷ֱ���ȡ1molH2SO4�������ϸ�����1molS����ת��6mole-
D. ;�������۱�;������Ⱦ���С��ԭ�������ʸߣ�������������ɫ��ѧ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A.ͨ��Ԫ�صĻ��ϼ�����ԭ�ӵ������������еĹ�ϵ
B.��֪ҿ��һ�ֺ����� ![]() Ir��������ڵ���������114
Ir��������ڵ���������114
C.![]() C��
C�� ![]() N����������ͬ������������ͬ�����Ի���Ϊͬλ��
N����������ͬ������������ͬ�����Ի���Ϊͬλ��
D.�ص�ԭ�ӽṹʾ��ͼΪ ![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2000��ŵ������ѧ��������״�Ӣ������λ��ѧ�ң��Ա��������ڵ���ۺ�����һ���������Ŀ����Թ��������Ƿ��ֺ�����CH=CH��CH=CH��CH=CH�������ֽṹ�ľۺ�����е����ԣ��ϳ��������ֽṹ�ۺ���������ǣ� ��
A.��ȲB.��ϩC.��ϩD.����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й������ʻ����Ӽ�����ж���ȷ���ǣ� ��
A.����Һ�еμӷ�̪��Һ����Һ�Ժ�ɫ��ԭ��Һ��NaOH
B.����ͨ����ˮ����ͭ����ĩ������ԭ�����к���ˮ����
C.���հ�ɫ��ĩ������ʻ�ɫ��ԭ��ĩ������
D.������ͨ�����ʯ��ˮ����Һ����ǣ�ԭ������CO2
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com