
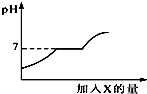
 现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示.则X是( )
现有盐酸和CaCl2的混合溶液,向其中逐滴加入过量某物质X,溶液的pH随滴入X的量的变化关系如图所示.则X是( )| A. | 水 | B. | 澄清石灰水 | C. | 纯碱溶液 | D. | 稀盐酸 |
分析 首先根据溶液酸碱性的变化来推断所加物质的酸碱性,能够根据溶液酸碱性的变化来推断物质间的反应,由于随着X的加入溶液由酸性逐渐的变为中性又变为碱性,因此X应是一种碱性物质,首先排除A、D,再就是图象的中间一段溶液的PH值没有发生变化,说明X也能与氯化钙发生反应,当把氯化钙也消耗完以后,再加X就会导致溶液变为碱性.所以X为纯碱溶液.
解答 解:由于随着X的加入溶液由酸性逐渐的变为中性又变为碱性,因此X应是一种碱性物质,首先排除A、D,再就是图象的中间一段溶液的PH值没有发生变化,说明X也能与氯化钙发生反应,当把氯化钙也消耗完以后,再加X就会导致溶液变为碱性.所以X为纯碱溶液,碳酸钠首先与盐酸反应,反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑,反应完成后,碳酸钠再与氯化钙反应生成沉淀,溶液PH等于7的过程中发生的化学方程式为CaCl2+Na2CO3=2NaCl+CaCO3↓,当PH大于7时,说明纯碱溶液过量,发生反应的化学方程式为:Na2CO3+2HCl=2NaCl+H2O+CO2↑,溶液中的溶质是NaCl和Na2CO3,
故选:C.
点评 本题考查溶液中溶质的判别,主要考查了对图象的分析,能够根据图象来推断物质间的反应,培养学生分析问题、解决问题的能力,题目难度中等.


科目:高中化学 来源: 题型:解答题
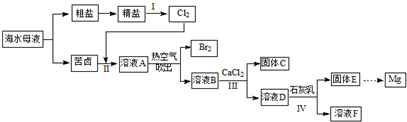
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
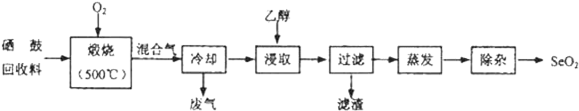
| 物质 | 熔点 | 沸点 | 溶解度 |
| SeO2 | 340℃(315℃升华) | 684℃ | 易溶于水和乙醇 |
| TeO2 | 733℃(450℃升华) | 1260℃ | 微溶于水,不溶于乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
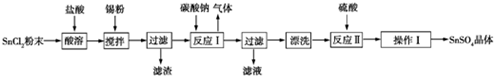
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
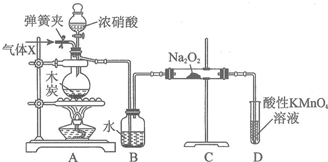
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃,1.01×105Pa,64 g SO2中含有的原子数为3NA | |
| B. | 常温常压下,1.06 g Na2CO3含有的Na+个数为0.02NA | |
| C. | 常温常压下,32 g O2和O3的混合气体所含原子数为2NA | |
| D. | 含有NA个氧原子的氧气在标准状况下的体积为22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| a、b可能的关系 | 生成的沉淀的质量/g |
| b≤3a | 2.6b |
| b≥4a | 0 |
| 3a<b<4a | 31.2a-7.8b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com