
【题目】如图为实验室制取纯净、干燥的氯气,并验证氯气性质的装置。其中E瓶放有干燥红色布条;F中为红色的铜网,其右端出气管口放有脱脂棉。
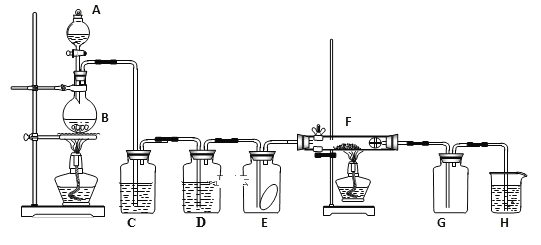
(1)写出实验室制氯气的化学方程式:___,表现还原性和酸性的盐酸物质的量之比为___。
(2)装置C中盛装的溶液是___,D中试剂的作用是___。
(3)E中的红色布条是否退色?___,F中的反应现象为____。
(4)新制氯水呈黄绿色说明其中含有____,(填化学式,下同),将AgNO3溶液滴入可观察到白色沉淀说明其中含有____。
(5)H中的试剂为___,用来吸收多余氯气。该反应的化学方程式为____。
【答案】MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑ 1:1 饱和食盐水 干燥氯气 否 产生大量棕黄色烟 Cl2 Cl- 氢氧化钠溶液 Cl2+2NaOH=NaCl+NaClO+H2O
MnCl2+2H2O+Cl2↑ 1:1 饱和食盐水 干燥氯气 否 产生大量棕黄色烟 Cl2 Cl- 氢氧化钠溶液 Cl2+2NaOH=NaCl+NaClO+H2O
【解析】
由题干及实验装置图可知,装置A、B为制备氯气的装置,装置C中盛装的是饱和食盐水,用于除去氯气中混有的HCl,装置D中盛装的是浓硫酸,用于干燥氯气,E中放有干燥的红色布条,干燥的氯气不能使干燥的红色布条褪色,F中为红色的铜网,氯气与红色的铜反应生成棕黄色的烟,主要成分为CuCl2,H为尾气吸收装置,盛装的是氢氧化钠溶液,据此分析作答。
(1)实验室用二氧化锰和浓盐酸加热制取氯气,反应方程式为:MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑;反应中盐酸作还原剂,同时还体现酸性,二氧化锰作氧化剂,表现还原性和酸性的盐酸物质的量之比为1:1;
MnCl2+2H2O+Cl2↑;反应中盐酸作还原剂,同时还体现酸性,二氧化锰作氧化剂,表现还原性和酸性的盐酸物质的量之比为1:1;
(2)装置C用于除去氯气中混有的HCl,因此盛装的溶液是饱和的氯化钠溶液;D中盛装的是浓硫酸,用于干燥氯气;
(3)E中放置的是干燥的红色布条,干燥的氯气不能使干燥的有色布条褪色,因此E中的红色布条不褪色;F中为红色的铜网,氯气与红色的铜反应生成棕黄色的烟,主要成分为CuCl2;
(4)新制氯水呈黄绿色说明其中含有Cl2;将AgNO3溶液滴入可观察到白色沉淀说明新制的氯水中存在Cl-;
(5)装置H用于吸收多余的氯气,盛装的是氢氧化钠溶液;氢氧化钠与氯气反应,生成氯化钠、次氯酸钠和水,反应方程式为:Cl2+2NaOH=NaCl+NaClO+H2O。


科目:高中化学 来源: 题型:
【题目】欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32-)、c(HCO3-)都减少,可采取的措施为( )
A.通入二氧化碳气体B.加入氢氧化钠固体
C.通入氯化氢气体D.加入饱和石灰水溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y、Z是三种原子序数依次增大的短周期元素。甲、乙、丙分别是三种元素形成的单质,A、B、C、D分别是由三种元素中的两种形成的化合物,且A与C中均含有10 个电子。它们之间转化关系如下图所示。下列说法正确的是

A. 原子半径:Z>Y>X
B. X与Y形成的化合物只含极性键
C. Y有多种同素异形体,且均具有高熔点、高沸点、硬度大的性质
D. 气态氢化物的稳定性:A<C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.液态HCl不导电,所以HCl是非电解质
B.NH3、CO2的水溶液能导电,所以NH3、CO2是电解质
C.铜、石墨均能导电,所以它们都是电解质
D.蔗糖在水溶液中或熔融时均不导电,所以是非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列问题:
(1)10Be和9Be______________。
a.是同一种原子 b.具有相同的中子数
c.具有相同的化学性质 d.具有相同的核外电子排布
(2)有下列微粒或物质:
①![]() O、
O、![]() O、
O、![]() O ②H2O、D2O ③石墨、金刚石 ④H2、D2、T2 ⑤H、D、T ⑥
O ②H2O、D2O ③石墨、金刚石 ④H2、D2、T2 ⑤H、D、T ⑥![]() K、
K、![]() Ca、
Ca、![]() Ar,回答下列问题:
Ar,回答下列问题:
a.互为同位素的是______________;
b.互为同素异形体的是______________;
c.由①和⑤中的微粒能结合成水,可得水分子的种数为__________种;可得相对分子质量不同的水分子种数为__________种,相对分子质量最大的是____________(写化学式)。
(3)![]() H2
H2![]() O的摩尔质量为____________,相同质量的
O的摩尔质量为____________,相同质量的![]() H2
H2![]() O与
O与![]() H2
H2![]() O所含质子数之比为______,中子数之比为__________。
O所含质子数之比为______,中子数之比为__________。
(4)电解相同质量的![]() H2
H2![]() O和
O和![]() H2
H2![]() O时产生的氢气在同温同压下体积之比为__________,质量之比为__________。
O时产生的氢气在同温同压下体积之比为__________,质量之比为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠可由亚硫酸钠和硫粉通过化合反应制得:Na2SO3+S=Na2S2O3,常温下溶液中析出晶体为Na2S2O35H2O,Na2S2O35H2O于4045℃熔化,48℃分解:Na2S2O3易溶于水,不溶于乙醇。在水中有关物质的溶解度曲线如图1所示。
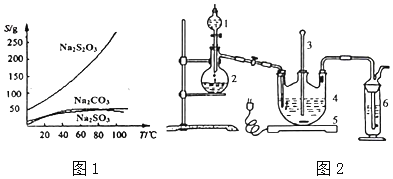
I.现按如下方法制备Na2S2O35H2O:
将硫化钠和碳酸钠按反应要求比例一并放入三颈烧瓶中,注入150mL蒸馏水使其溶解,在分液漏斗中,注入浓硫酸,在装置2中加入亚硫酸钠固体,并按如图2示安装好装置。
(1)仪器2的名称为___,装置6中可加入___。
A.BaCl2溶液 B.浓H2SO4 C.酸性KMnO4溶液 D.NaOH溶液
(2)打开分液漏斗活塞,注入浓盐酸使反应产生的二氧化硫气体较均匀的通入Na2S和Na2CO3的混合溶液中,并用磁力搅拌器搅动并加热,反应原理为:
①Na2CO3+SO2═Na2SO3+CO2
②Na2S+SO2+H2O═Na2SO3+H2S
③2H2S+SO2═3S↓+2H2O
④Na2SO3+S![]() Na2S2O3
Na2S2O3
总反应为:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2
随着SO2气体的通入,看到溶液中有大量浅黄色固体析出,继续通SO2气体,反应约半小时。当溶液中pH接近或不小于7时,即可停止通气和加热。溶液pH要控制不小于7的理由是:___(用文字和相关离子方程式表示)。
Ⅱ.分离Na2S2O35H2O并测定含量:
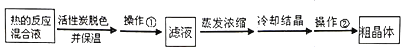
(3)为减少产品的损失,操作①为___,操作②是抽滤洗涤、干燥,其中洗涤操作是用___(填试剂名称)作洗涤剂。
(4)蒸发浓缩滤液,直至溶液呈微黄色浑浊为止。蒸发时要控制温度不宜过高,其原因是___。
(5)制得的粗产品中往往含有少量杂质。为了测定粗产品中Na2S2O35H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定杂质与酸性KMnO4溶液不反应)。称取1.28g粗样品溶于水,用(0.40mol/LKMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O![]() 全部被氧化时,消耗KMnO4溶液20.00mL。(5S2O
全部被氧化时,消耗KMnO4溶液20.00mL。(5S2O![]() +8MnO
+8MnO![]() +14H+=8Mn2++10SO
+14H+=8Mn2++10SO![]() +7H2O)
+7H2O)
试回答:
①滴定终点时的颜色变化___
②产品中Na2S2O35H2O的质量分数为___
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)中,表示该反应速率最快的是:
3C(g)+4D(g)中,表示该反应速率最快的是:
A.V(A)=0.5mol·L-1·s-1B.V(B)=0.3mol·L-1·s-1
C.V(C)=0.8mol·L-1·s-1D.V(D)=1mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A~H分别表示中学化学中常见的某种物质,它们之间的相互转化关系如下图所示(部分反应物、生成物未列出)。已知:C、D、E、F、G五种物质中均含有同一种元素;A为淡黄色固体化合物;G为红褐色固体。
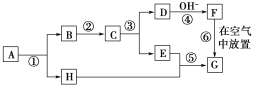
(1)写出化学式:A:________________;C:________________;F:________________。
(2)写出反应的化学方程式:
②_____________________________________________________________。
⑥_____________________________________________________________。
(3)写出离子方程式:
③_____________________________________________________________。
⑤_____________________________________________________________。
(4)生成24 g B需要转移________mol电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用海水可以提取溴和镁,提取过程如下。
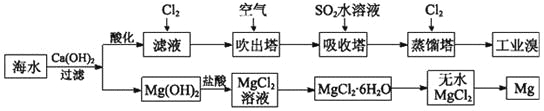
(1)提取溴的过程中,经过两次Br-→Br2转化的目的是________,吸收塔中发生反应的离子方程式是__________。用平衡移动原理解释通空气的主要目的是_______。
(2)从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是________________、过滤、洗涤、干燥。
(3)依据上述流程,若将10 m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为________L(忽略Cl2的溶解)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com