
| A. | Ag、Cu两种单质的混合物 | B. | Cu、Fe两种单质的混合物 | ||
| C. | Ag、Fe两种单质的混合物 | D. | Ag、Cu、Fe三种单质的混合物 |
分析 根据在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来分析,充分反应后过滤,向含有AgNO3、Cu(NO3)2的混合溶液中加入一定量的铁粉,向滤出的固体中滴加稀硫酸,有气泡产生,此现象说明Fe过量没有反应完,所以原混合溶液中的AgNO3、Cu(NO3)2,全部被置换生成Cu、Ag,Zn(NO3)2和铁不反应.
解答 解:根据金属活动性:Zn>Fe>Cu>Ag,则混合溶液中的AgNO3、Cu(NO3)2能与铁发生置换反应,得到Cu、Ag,而Zn(NO3)2和铁不反应,向含有AgNO3、Cu(NO3)2的混合溶液中加入一定量的铁粉,则充分反应后过滤,向滤出的固体中滴加稀硫酸,有气体生成,说明铁粉过量,所以滤出固体中含Fe和置换出Cu、Ag,
故选D.
点评 本题主要考查了根据金属活动性顺序判断反应的发生,从而确定物质的存在,培养学生的分析能力和理解能力,难度中等.


科目:高中化学 来源: 题型:解答题
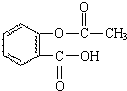 化学和环境保护、食品营养、材料应用等密切相关.
化学和环境保护、食品营养、材料应用等密切相关. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、K-、CIO-、Fe2+ | B. | OH-、Na+、Mg2+、Br- | ||
| C. | Cu2+、H+、CI-、NO3- | D. | Na+、SiO32-、Ca2+、CI- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有单质铁生成 | B. | 有气泡产生、最终有白色沉淀生成 | ||
| C. | 氧化剂只有H20 | D. | 被氧化的元素有钠、铁两种元素. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | pH相同的①CH3COONa;②NaHCO3;③NaAlO2三份溶液中的c(Na+):③>②>① | |
| B. | 25℃时①10-3mol/L的盐酸;②pH=3的NH4Cl溶液;③pH=11的氨水中,水的电离程度为:②>③>① | |
| C. | 图中a点溶液中各离子浓度的关系是:c(OH-)=c(H+)+c(CH3COO-)+2c(CH3COOH) | |
| D. | 图中pH=7时c(Na+)>c(CH3COO-)>c(OH-)=c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com