
����Ŀ���ش��������⣺
��1�����߷�һ��������ʹ���˴������ػ��������ƽ�����װ�л�ԭ����(N2H4)��ǿ��������������(H2O2)���䷴ӦΪN2H4(l)+2H2O2(l)=N2(g)+4H2O(g)���÷�Ӧ����1molH2O(g)�ͷų�160.4kJ������
��H2O2�ĵ���ʽΪ______��
������Ӧ��O-H��������16mol����Ӧ�ͷų�������Ϊ______kJ��
��2���������ؾ��������ܶȴ�ѹ�ߡ��ɶ�η�����ŵ�����ԣ��õ�طŵ�ʱ��������ӦʽΪ2NiOOH+2H2O+2e-=2Ni(OH)2+2OH-��������ӦʽΪH2+2OH-+2e-=2H2O��
�ٸ��������طŵ�ʱ�ĵ���ܷ�ӦΪ____��
�ڸõ�طŵ�ʱ��OH-��____(�����������������������ƶ���
�ۼ���õ�طŵ�ʱ��2.408��1024�����ӴӸ������������������ĵ�H2�ڱ�״���µ����Ϊ____L��
���𰸡�![]() 2566.4 2NiOOH+H2=2Ni(OH)2 ���� 44.8
2566.4 2NiOOH+H2=2Ni(OH)2 ���� 44.8
��������
���������Ϣ����ѧ���仯���㷴Ӧ����ЧӦ������ԭ���ԭ���������ӵ��ƶ������ݵ缫��Ӧʽ������ؼ��㡣
��1����H2O2���ڹ��ۻ������ԭ�Ӽ�ͨ�����õ��ӶԽ�ϣ������ʽΪ![]() ��
��
��ÿ��ˮ�����к���2��O-H����ÿ��˫��ˮҲ����2��O-H�������ݷ���ʽ֪��ÿ����4molˮ������4molO-H��������Ӧ��O-H��������16mol����˵������16molˮ�����������Ϣ����1molˮ�ͷ�160.4kJ��������Ӧ�ͷų�������Ϊ160.4kJ��16=2566.4kJ��
��2����������Ӧʽ���ϸ�����Ӧʽ�õ��õ�ص��ܷ�Ӧ�� 2NiOOH+H2=2Ni(OH)2��
���õ�طŵ�ʱ�����ݸ�����Ӧʽ֪��OH-�ڸ���������Ӧ���������ƶ���
�����ݸ�����Ӧʽ���㣺n(H2)=1/2n(e-)=1/2��![]() =2mol��V(H2)=22.4mol/L��2mol=44.8L��
=2mol��V(H2)=22.4mol/L��2mol=44.8L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ�������Ӿ������ЧӦ������,��ѧ�������о���������ͼ��ʾ�Ķ�����̼��ѭ����ϵ��
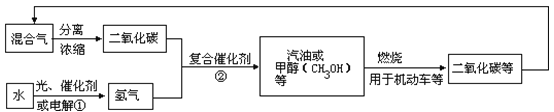
������ϵͼ�ܷ�ӳ�Ļ�ѧ�۵��ѧ˼���� ( )
�ٻ�ѧ�仯��Ԫ���������غ������ȼ��ʱ��ѧ�ܿ���ת��Ϊ���ܺ������۹��ܻ���ܿ���ת��Ϊ��ѧ������������л�������ת�����ݶ�����̼Ҳ��һ����Ҫ����Դ��
A. �٢ڢ� B. �٢ڢܢ� C. �٢ܢ� D. �٢ڢۢܢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶���,����̼����MCO3��M�ֱ�ΪA��B�������ӣ��ij����ܽ�ƽ��������ͼ��ʾ����֪��pM=lgc(M)��p(CO32)=lgc(CO32)����֪ACO3��BCO3�ܽ�ȸ����������������ӵ�ˮ�⣩������˵����ȷ����

A. ��a��ʾACO3���ܽ�ƽ������
B. ���¶��£���ACO3�ı�����Һ�м���Na2CO3��Һ��һ���ܲ�������
C. ��0.1L 1mol/L��BCl2��Һ�м���Na2CO3���壬������Na2CO3���������Ϊ116.6gʱ��B2+����ǡ�ó�����ȫ��B2+����Ϊ10��5mol/Lʱ��Ϊ������ȫ��
D. ACO3��Ksp=10��4.4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ��ֻ���ܺ�������K+��NH4+��Fe2+��Al3+��Cl-��SO42-��CO32-��AlO2-�е����������ӣ�����Ũ�Ⱦ�Ϊ0.1mol��L-1��ijͬѧ����������ʵ�飺
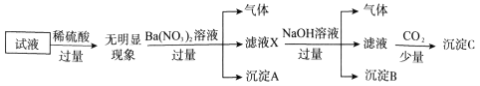
����˵����ȷ���ǣ� ��
A. ��ȷ��ԭ��Һ���Ƿ���Al3+��Cl-
B. ��ҺX�д������ڵ���������NH4+��Fe2+��Ba2+
C. ��ȷ������C�ijɷ�
D. ԭ��Һ�д��ڵ�����ΪNH4+��Fe2+��Cl-��SO42-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��C(s)��O2(g)===CO2(g) ��H1
CO2(g)��C(s)===2CO(g) ��H2
2CO(g)��O2(g)===2CO2(g) ��H3
2Cu(s)��O2(g)===2CuO(s) ��H4
CO(g)��CuO(s)===CO2(g)��Cu(s) ��H5
���й���������Ӧ�ʱ���ж���ȷ����( )
A. ��H1>0����H3<0 B. ��H2<0����H4>0
C. ��H2����H1����H3 D. ��H3����H4����H1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��I.��͵���������ֱ���ŷŻ��������صĻ������⣬��ش��������⣺
��1�����л���������Ҫ����������͵���������ŷ���������_______________��
A.ȫ���ů B.���� C.ˮ�帻Ӫ������ˮ���� D.��ɫ��Ⱦ
��2��SO2���ŷ���Ҫ������ú��ȼ�ա�����ʯ��ʯ���������������������ϡ�
��֪��CaCO3(s)==CO2(g)+CaO(s) ��H=+178.2kJ/mol
SO2(g)+CaO(s)==CaSO3(s) ��H=-402kJ/mol
2CaSO3(s)+O2(g )==2CaSO4(s) ��H=-234.2kJ/mol
д��ʯ��ʯ������Ȼ�ѧ��Ӧ����ʽ_________________________________��
��.NOx���ŷ���Ҫ����������β��������NO2 ��NO����������û���̿��NOx����������������Ӧ���£�
��Ӧa��C(s)+2NO(g)![]() N2(g)+CO2(g) ��H=-34.0kJ/mol
N2(g)+CO2(g) ��H=-34.0kJ/mol
��Ӧb��2C(s)+2NO2(g)![]() N2(g)+2CO2(g) ��H=-64.2kJ/mol
N2(g)+2CO2(g) ��H=-64.2kJ/mol
��3�����ڷ�Ӧa����T1��ʱ��������������÷�Ӧ�ڲ�ͬʱ����ϸ����ʵ�Ũ�����£�
ʱ�䣨min�� Ũ�ȣ�mol��L-1�� | 0 | 10 | 20 | 30 | 40 | 50 |
NO | 1.00 | 0. 58 | 0. 40 | 0. 40 | 0. 48 | 0. 48 |
N2 | 0 | 0. 21 | 0.30 | 0. 30 | 0. 36 | 0. 36 |
��0~10min�ڣ�NO��ƽ����Ӧ����v(NO)=_____�������߷�Ӧ�¶ȣ��÷�Ӧ��ƽ�ⳣ��K____________(ѡ���������С�����䡱)��
��30min��ֻ�ı�ijһ��������Ӧ���´ﵽƽ�⣻�����ϱ��е������жϸı������������_________������ĸ����
a.����һ�����Ļ���̿ b.ͨ��һ������NO
c.�ʵ���С��������� d.������ʵĴ���
��4��ijʵ����ģ�ⷴӦb�����ܱ������м���������C ��һ������NO2���壬ά���¶�ΪT2�棬��ͼΪ��ͬѹǿ�·�Ӧb������ͬʱ��NO2��ת��������ѹǿ�仯��ʾ��ͼ
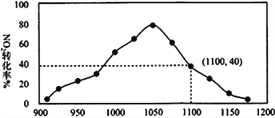
��Ӷ���ѧ�Ƕȷ�����1050 kPa ǰ����Ӧb ��NO2ת��������ѹǿ����������ԭ��____________����1100 kPaʱ��NO2���������Ϊ_________________________��
��5����ij���ʵ�ƽ���ѹ���������ʵ���Ũ��Ҳ���Ա�ʾ��ѧƽ�ⳣ��������Kp������T2�桢1.1��106Paʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��Kp=___________���������ʽ��ʾ������֪�������ѹ(p��)=������ѹ(p��)�� ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
A. �����ǵ�ȼ������2800 kJ/mol����![]()
B. ��֪2C(s)��O2(g)===2CO(g)��H����221 kJ/mol����÷�Ӧ�ķ�Ӧ��Ϊ221 kJ��mol-1
C. ��֪ϡ��Һ�У�H+ (aq)��OH- (aq)===H2O(l)��H����57.3 kJ��mol-1 ����ϡ������ϡ����������Һ��Ӧ����1 molˮʱ�ų�57.3 kJ������
D. ��֪HCl��NaOH��Ӧ���к��Ȧ�H����57.3 kJ��mol-1����98%��Ũ������ϡ����������Һ��Ӧ����1 molˮ���к���Ϊ��57.3 kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����Ƽ��仯�����������ȷ����
A.�����ƿ��Ա�������ˮ�ƾ���
B.����ʱ̼�����Ʊ�̼�����ȶ�
C.�������ƿ�����������ߵĹ�����
D.�����ò���ƿʢ��ϡ����������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£���һ�����ܱ������У��ܱ�ʾ��ӦX(g)+Y(g) ![]() 2Z(g)һ���ﵽƽ��״̬���ǣ� ��
2Z(g)һ���ﵽƽ��״̬���ǣ� ��
��������������ܶȲ��ٷ����仯
��X��Y��Z��Ũ�Ȳ��ٷ����仯
�������е�ѹǿ���ٷ����仯
����λʱ��������n mol Y��ͬʱ����2n mol Z
A���٢� B���ڢ� C���ۢ� D���٢�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com