
| A. | 原子序数:W>X>Y>Z | |
| B. | 原子半径:W>X>Y>Z | |
| C. | W的最高价氧化物的水化物碱性比X的弱 | |
| D. | Y的简单氢化物的稳定性比Z的强 |
分析 在电治铝的电解槽中存在电解质W2[X2Y2Z4],四种元素的简单离子的电子层结构均相同,Y原子最外层电子数为次外层的3倍,原子只能有2个电子层,最外层电子数为6,故Y为O元素;
X原子最外层电子数为Y原子最外层电子数的一半,其最外层电子数为3,则X为Al;
该化合物中W应该带正电荷,含有两个铝离子、两个O离子,Z应该带负电荷,根据化合物代数和为0知,W应该带一个单位正电荷,Z带一个单位负电荷,且这四种简单离子电子层结构相同,所以W为Na、Z为F元素,则该电解质为Na2[Al2O2F4].
A.通过以上分析判断原子序数;
B.原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小;
C.元素的金属性越强,其最高价氧化物的水化物碱性越强;
D.元素的非金属性越强,其气态氢化物的稳定性越强.
解答 解:在电治铝的电解槽中存在电解质W2[X2Y2Z4],四种元素的简单离子的电子层结构均相同,Y原子最外层电子数为次外层的3倍,原子只能有2个电子层,最外层电子数为6,故Y为O元素;X原子最外层电子数为Y原子最外层电子数的一半,其最外层电子数为3,则X为Al;该化合物中W应该带正电荷,含有两个铝离子、两个O离子,Z应该带负电荷,根据化合物代数和为0知,W应该带一个单位正电荷,Z带一个单位负电荷,且这四种简单离子电子层结构相同,所以W为Na、Z为F元素,则该电解质为Na2[Al2O2F4].
A.通过以上分析知,原子序数X>W>Z>Y,故A错误;
B.原子电子层数越多其原子半径越大,同一周期元素,原子半径随着原子序数增大而减小,所以原子半径:W(Na)>X(Al)>Y(O)>Z(F),故B正确;
C.元素的金属性越强,其最高价氧化物的水化物碱性越强,金属性W>X,所以W的最高价氧化物的水化物碱性比X的强,故C错误;
D.元素的非金属性越强,其气态氢化物的稳定性越强,非金属性Z>Y,所以Y的简单氢化物的稳定性比Z的弱,故D错误;
故选B.
点评 本题考查原子结构、元素周期律,侧重考查分析推断综合应用能力,正确推断元素是解本题关键,熟练掌握元素周期律知识,题目难度中等.


科目:高中化学 来源: 题型:解答题
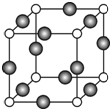 已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子.
已知 A、B、C、D是原子序数依次增大的四种短周期主族元素,A的周期数等于其主族序数,B原子的价电子排布为nsnnpn,D是地壳中含量最多的元素.E是第四周期的p区元素且最外层只有2对成对电子,F元素的基态原子第四能层只有一个电子,其它能层均已充满电子.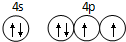 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 房屋装修所用装饰材料释放出的甲醛、苯、氨等气体对人体无害,不会造成污染 | |
| B. | 食品包装袋小包内盛有装氧化钙或生石灰用作食品的抗氧化剂 | |
| C. | 制作航天服的聚酯纤维和“天宫一号”中使用的碳纤维都是新型无机非金属材料 | |
| D. | 绿色化学的核心就是利用化学原理从源头减少和消除工业对环境的污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有羟基的化合物一定属于醇类 | |
| B. | 含有跟链烃基相连的羟基的有机物一定是醇类 | |
| C. | 酚类和醇类具有相同的官能团,因而具有相同的化学性质 | |
| D. | 分子内有苯环和羟基的化合物一定是酚类 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯中的甲苯(溴水) | B. | 乙烷中的乙烯(氢气) | ||
| C. | 溴苯中的溴(碘化钾溶液) | D. | 乙醇中的水(新制的CaO) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li | B. | S | C. | Li2S | D. | Li和S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热时间太短 | B. | 不应冷却后再加入AgNO3溶液 | ||
| C. | 加AgNO3溶液前未用稀硝酸酸化 | D. | 反应后的溶液中不存在Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3、CO2、HCl | B. | H2、Cl2、H2S | C. | NH3、O2、H2 | D. | CO2、H2S、SO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

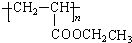 .
. .
. 与
与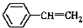 也可以发生类似反应①的反应,其有机产物的结构简式为:
也可以发生类似反应①的反应,其有机产物的结构简式为: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com