
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案科目:高中化学 来源: 题型:
(1)(4分)物质的量是一个联系宏观和微观的物理量。填写关于物质的量计算的四个恒等式(NA表示阿伏加德罗常数):
n= = = = 。
(2)(5分)同温同压下,同体积的N2和SO2分子数之比为 ,物质的量之比为 ,原子总数之比为 ,摩尔质量之比为 ,质量之比为 。
(3)(1分)若某原子的摩尔质量为M g·mol-1,则一个该原子的真实质量是__________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
用标准的KOH溶液滴 定未知浓度的盐酸,若测定结果偏低,其原因可能是( )
定未知浓度的盐酸,若测定结果偏低,其原因可能是( )
A.配制标准溶液的固体KOH中混有NaOH杂质
B.滴定终点读数时,俯视滴定管的刻度,其他操作正确
C.盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗
D.滴定到终点读数时,发现滴定管尖嘴处悬挂一滴溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
室温下,在0.2 mol·L-1 Al2(SO4)3溶液中,逐滴加入1.0 mol·L-1 NaOH溶液,实验测得溶液pH随NaOH溶液体积的变化曲线如图所示,下列有关说法正确的是( )
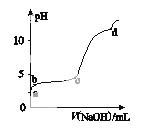
A.a点时,溶液呈酸性的原因是Al3+水解,离子方程式为Al3++3OH- Al(OH)3
Al(OH)3
B.a~b段,溶液pH增大,Al3+浓度不变
C.b~c段,加入的OH-主要用于生成Al(OH)3沉淀
D.d点时,Al(OH)3沉淀开始溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 (25℃) | Ki=1.77×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
下列选项错误的是
A.2CN-+H2O+CO2→2HCN+CO32-
B.2HCOOH+CO32-→2HCOO-+H2O+CO2↑
C.中和等体积、等pH的HCOOH和HCN消耗NaOH的量前者小于后者
D.等体积、等浓度的HCOONa和NaCN溶液中所含离子总数前者小于后者
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO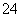 )>c(NH
)>c(NH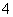 )
)
B.两种醋酸溶液的物质的量浓度分别为c1和c2,pH分别为a和a+1,则c1=10c2
C.pH=11的NaOH的溶液与pH=3的醋酸溶液等体积混合,滴入石蕊试液呈红色
D.向0.1 mol/L的氨水中加入少量硫酸铵固体,则溶液中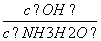 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
Fe(OH)3胶体和MgCl2溶液共同具有的性质有
A.两分散系均有丁达尔现象 B.都比较稳定,密封放置不产生沉淀
C.加入盐酸先产生沉淀,随后溶解  D.分散质微粒可通过半透膜
D.分散质微粒可通过半透膜
查看答案和解析>>
科目:高中化学 来源: 题型:
下列电离方程式错误的是
A.CaCl2 =Ca2++2Cl- B.Ba(OH)2=Ba2++2OH-
C.HNO3=H++NO3- D.NaHCO3=Na++H++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
硫酸铵溶液中离子浓度关系不正确的是 ( )
A.c(NH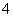 )>c(SO
)>c(SO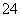 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
B.c(NH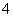 )=2c(SO
)=2c(SO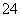 )
)
C.c(NH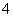 )+c(NH3·H2O)=2c(SO
)+c(NH3·H2O)=2c(SO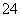 )
)
D.c(NH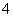 )+c(H+)=c(OH-)+2c(SO
)+c(H+)=c(OH-)+2c(SO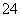 )
)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com