
H2O2是一种二元弱酸,对于0.1 mol·L-1的过氧化氢溶液,下列叙述不正确的是( )
A.H2O2的电离方程式可写作H2O2 H++HO2-,HO2-
H++HO2-,HO2- H++O42-
H++O42-
B.加水稀释过程中,K1(H2O2)增大,α(H2O2)增大,c(H+)增大
C.加入少量浓盐酸,过氧化氢的电离平衡逆向移动,水的电离平衡逆向移动
D.加入少量氯化铁溶液,溶液中产生大量气泡
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练9-2练习卷(解析版) 题型:选择题
如图是模拟电化学反应装置图。下列说法正确的是( )
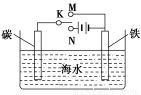
A.开关K置于N处,则铁电极的电极反应式为:Fe-2e-=Fe2+
B.开关K置于N处,可以减缓铁的腐蚀
C.开关K置于M处,则铁电极的电极反应式为:2Cl--2e-=Cl2↑
D.开关K置于M处,电子从碳棒经开关K流向铁棒
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-3练习卷(解析版) 题型:选择题
室温下,将1.000 mol·L-1盐酸滴入20.00 mL 1.000 mol·L-1氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示。下列有关说法正确的是( )

A.a点由水电离出的c(H+)=1×10-14 mol/L
B.b点:c(NH4+)+c(NH3·H2O)=c(Cl-)
C.c点:c(Cl-)=c(NH4+)
D.d点后,溶液温度略下降的主要原因是NH3·H2O电离吸热
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-2练习卷(解析版) 题型:选择题
对于常温下pH为1的硝酸溶液,下列叙述正确的是( )
A.该溶液1 mL稀释至100 mL后,pH等于3
B.向该溶液中加入pH为13的氢氧化钡溶液恰好完全中和
C.该溶液中硝酸电离出的c(H+)与水电离出的c(H+)之比值为10-12
D.该溶液中水电离出的c(H+)是pH为3的硝酸中水电离出的c(H+)的100倍
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-1练习卷(解析版) 题型:选择题
对室温下氢离子浓度、体积均相同的HCl溶液和CH3COOH溶液分别采取以下措施,
有关叙述正确的是( )
A.加适量的CH3COONa晶体,两溶液的氢离子浓度减小
B.使温度升高20 ℃,两溶液的氢离子浓度不变
C.加水稀释2倍,两溶液的氢离子浓度增大
D.加足量的Zn充分反应后,两溶液中产生的氢气一样多
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练7-3练习卷(解析版) 题型:填空题
已知可逆反应:A(g)+B(g)  C(g)+D(g) ΔH<0。请回答下列问题:
C(g)+D(g) ΔH<0。请回答下列问题:
(1)在某温度下,反应物的起始浓度分别为:c(A)=1 mol/L,c(B)=2.4 mol/L,达到平衡时,A的转化率为60%,此时B的转化率为 。
(2)若反应温度降低,则B的转化率将 (填“增大”、“减小”或“不变”)。
(3)若反应温度不变,反应物的起始浓度分别为c(A)=4 mol·L-1,c(B)=a mol·L-1,达到平衡后c(C)=2 mol·L-1,则a= 。
(4)若反应温度不变,反应物的起始浓度分别为c(A)=c(B)=b mol/L,达到平衡后c(D)= 。(保留两位有效数字)
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练7-3练习卷(解析版) 题型:选择题
某温度下,在一个2 L的密闭容器中加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)  4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( )
4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是( )
A.前2 min,D的平均反应速率为0.2 mol·L-1·min-1
B.此时,B的平衡转化率是40%
C.增大该体系的压强,平衡不移动,化学平衡常数不变
D.增加B,平衡向右移动,B的平衡转化率增大
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练7-2练习卷(解析版) 题型:选择题
在100 ℃时,将0.40 mol二氧化氮气体充入2 L密闭容器中,每隔一段时间对该容器内
的物质进行分析,得到如下数据:
时间(s) | 0 | 20 | 40 | 60 | 80 |
n(NO2)/mol | 0.40 | n1 | 0.26 | n3 | n4 |
n(N2O4)/mol | 0.00 | 0.05 | n2 | 0.08 | 0.08 |
下列说法中正确的是( )
A.反应开始20 s内以二氧化氮表示的平均反应速率为0.001 25 mol·L-1·s-1
B.80 s时混合气体的颜色与60 s时相同,比40 s时的颜色深
C.80 s时向容器中加入0.32 mol氦气,同时将容器扩大为4 L,则平衡将不移动
D.若起始投料为0.20 mol N2O4,相同条件下达平衡,则各组分含量与原平衡体系对应相等
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练5-3练习卷(解析版) 题型:选择题
甲、乙、丙、丁四种物质均为只含两种元素的化合物,且均含18个电子。下列有关这
四种物质的推断,正确的是( )
A.可能在某种物质中含有离子键
B.四种物质都是共价化合物
C.四种物质都不可能具有强氧化性
D.有一种物质是乙烷的同系物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com