
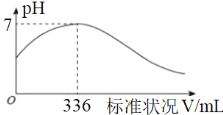
【题目】短周期主族元素X、Y、Z、Q、R的原子序数依次增大,X的简单阴离子与锂离子具有相同的电子层结构,Y原子最外层电子数等于内层电子数的2倍,Q的单质与稀硫酸剧烈反应生成X的单质。向100mL X2R的水溶液中缓缓通入RZ2气体,溶液pH与RZ2体积关系如图。下列说法错误的是
A.单质的沸点:Q>Z>XB.X2R溶液的浓度为0.3 molL-1
C.简单气态氢化物稳定性Z>R>YD.将RZ2分别通入BaCl2、Ba(NO3)2溶液中,均无明显现象
【答案】D
【解析】
由X的简单阴离子与锂离子具有相同的电子层结构可知,X为H元素;由Y原子最外层电子数等于内层电子数的2倍可知,Y为C元素;由向100mL X2R的水溶液中缓缓通入RZ2气体,溶液pH与RZ2体积关系示意图可知,Z为O元素、R为S元素;短周期主族元素X、Y、Z、Q、R的原子序数依次增大,Q的单质与稀硫酸剧烈反应生成X的单质可知,Q为Na、Mg、Al三种元素中的一种。
A项、Q单质为Na、Mg、Al三种金属固体单质中的一种,Z的单质为氧气,X的单质为氢气,三种单质的沸点由大到小的顺序为Q>Z>X,故A正确;
B项、二氧化硫和硫化氢反应的化学方程式为2H2S+SO2=3S↓+2 H2O,由图可知336ml二氧化硫与100mL H2S的水溶液恰好完全反应,由方程式可知硫化氢的物质的量为2×![]() =0.03mol,则 100mLH2S的水溶液浓度为
=0.03mol,则 100mLH2S的水溶液浓度为![]() =0.3mol/L,故B正确;
=0.3mol/L,故B正确;
C项、元素的非金属性越强,对应简单气态氢化物稳定性越强,非金属的强弱顺序为O>S>C,则简单气态氢化物稳定性由大到小的顺序为Z>R>Y,故C正确;
D项、将二氧化硫通入硝酸钡溶液中会生成硫酸钡白色沉淀,故D错误;
故选D。


科目:高中化学 来源: 题型:
【题目】现有二氧化硫—空气质子交换膜燃料电池,其原理如图所示。下列说法不正确的是
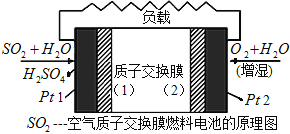
(注:质子指H+,质子交换膜仅允许H+通过)
A. Pt2电极附近发生的反应为:O2+4e-+2H2O=4OH-
B. 该电池工作时质子从Pt1电极经过内电路流到Pt2电极
C. Pt1电极附近发生的反应为:SO2+2H2O-2e-=SO42-+4H+
D. 该电池实现了制硫酸、发电、环保三位一体的结合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A.室温下用稀NaOH溶液吸收Cl2:Cl2+2OH-=ClO-+Cl-+H2O
B.用铝粉和NaOH溶液反应制取少量H2:Al+2OH-=[Al(OH)4]-+H2↑
C.室温下用稀HNO3溶解铜:Cu+2NO3-+2H+=Cu2++2NO2↑+H2O
D.向Na2SiO3溶液中滴加稀盐酸:Na2SiO3+2H+=H2SiO3↓+2Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】晶体硅是一种重要的非金属材料,有科学家认为硅是“21世纪的能源”、“未来的石油”。
(1)工业上生产纯硅的工艺流程如下:
![]()
石英砂的主要成分是SiO2,在制备粗硅时,焦炭的作用是__________(填“氧化剂”或“还原剂”);在该反应中,若消耗了3.0 g SiO2 ,则转移电子的总数为_______________。
(2)某实验室利用SiHCl3(沸点33.0 ℃)与过量H2在1 000 ℃~1 100 ℃反应制得纯硅。已知SiHCl3能与H2O强烈反应,在空气中易自燃。装置如图所示(热源及夹持装置略去)。
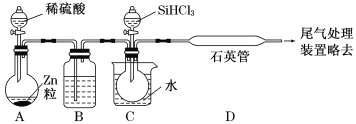
①装置B中的试剂是___________。装置C中的烧瓶需要加热,其目的是_________________。
②反应一段时间后,装置D中观察到的现象是______________________;装置D中发生反应的化学方程式为___________________________________。
③为检验产品硅中是否含微量铁单质,将试样用稀盐酸溶解,取上层清液后需要加入的试剂有______(填字母)。
a.碘水 b.氯水 c.Na2SO3溶液 d.KSCN溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铝混合物投入200mL硫酸中,固体全部溶解后,向所得溶液中加入5mol/L的NaOH溶液,生成沉淀的物质的量n与加入NaOH溶液的体积V的变化如图所示。
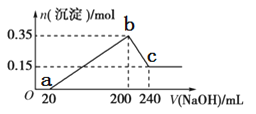
(1)写出bc段发生的化学反应方程式___;
(2)镁和铝的总质量为___g;
(3)b点溶液中的溶质为___,硫酸的物质的量浓度为___mol/L;
(4)生成的氢气在标准状况下的体积为___L;
(5)c点溶液中通入足量的CO2的反应化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用下图所示的有机物X可生产S诱抗素Y。下列说法正确的是
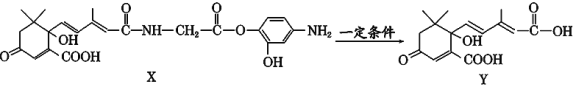
A. X结构中有2个手性碳原子
B. X可以发生氧化、取代、酯化、加聚、缩聚反应
C. Y既可以与FeCl3溶液发生显色反应,又可使酸性KMnO4溶液褪色
D. 1 mol X与足量NaOH溶液反应,最多消耗4 mol NaOH,1 mol Y最多能加成4 molH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组拟探究CO2和锌粒反应是否生成CO,已知CO能与银氨溶液反应产生黑色固体。实验装置如图所示:下列叙述正确的是

A.装置e的作用是防倒吸
B.根据图a的现象判断活塞K一定处于关闭状态
C.实验结束时,先关闭活塞K,再熄灭酒精灯
D.b、c、f中的试剂依次为饱和碳酸钠溶液、浓硫酸、银氨溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室利用氯气和苯反应制少量氯苯,可用如图装置。请回答下列问题:
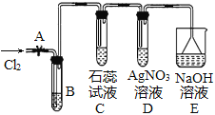
(1)大试管B中装少量铁屑和![]() 试管的苯,将导管伸入试管B底部,打开A,缓缓通入经过净化的氯气,先看到苯呈黄色,片刻后C、D导管口有白雾。B中发生的有机化学反应方程式为_____。B大试管上的长直导管的作用_____。
试管的苯,将导管伸入试管B底部,打开A,缓缓通入经过净化的氯气,先看到苯呈黄色,片刻后C、D导管口有白雾。B中发生的有机化学反应方程式为_____。B大试管上的长直导管的作用_____。
(2)C试管内出现的现象为_____;D试管内出现的现象为____。C、D试管里的导管没有插入溶液中的原因是______。
(3)将导管伸入试管B底部的目的是_____。
(4)反应完成后,将B中的液体倒入装在一定量水的烧杯中,可以得到橙黄色不溶于水的油状液体沉于烧杯底部,通过____操作,可以得到粗氯苯。从粗氯苯中除去溶解的氯气,用NaOH溶液处理后再洗涤,反应的离子方程式为____。
(5)本实验____(是或否)可以证明氯气和苯的反应是取代反应而不是加成反应,原因是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,二氧化硫和氧气发生如下反应:2SO2(g)+ O2 (g)![]() 2SO3(g) ΔH<0
2SO3(g) ΔH<0
(1)降低温度,该反应K值______,二氧化硫转化率____,化学反应速度____ ,(以上均填增大、减小或不变)
(2)600℃时,在一密闭容器中,将二氧化硫和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是_____。

(3)据图判断,反应进行至20min时,曲线发生变化的原因_____(用文字表达)
(4)10min到15min的曲线变化的原因可能是____(填写编号)。
a.加了催化剂 b.缩小容器体积 c.降低温度 d.增加SO3的物质的量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com