
【题目】实验室需要480mL 0.3 mol.·L-1 NaOH溶液和一定浓度的硫酸溶液。请回答:
(1)如图所示的仪器中,配制上述溶液一定不需要的仪器为__________(填选项字母),配制上述溶液还需用到的玻璃仪器为_________________(填仪器名称)。

(2)配制NaOH溶液。
①计算用托盘天平称取NaOH固体的质量为_____g。
②若NaOH溶液在转移至容量瓶时,洒落了少许,则所配制的溶液浓度将_______(填“偏高”、“偏低”或“无影响”)。
(3)配制硫酸溶液。
①实验室用98%(ρ=1.84g·cm3)的硫酸配制3.68mo·L-1的硫酸溶液500mL,需准确量取98%的硫酸的体积为_____mL。
②该同学实际配制硫酸溶液的浓度为3.50mol·L-1,原因可能是_________(填选项字母)。
A.用胶头滴管加水定容时俯视刻度
B.容量瓶中原来存有少量水
C.稀释硫酸的烧杯未洗涤
D.用胶头滴管加水定容时仰视刻度
【答案】AC 烧杯、玻璃棒 6.0 偏低 100mL CD
【解析】
配制一定物质的量浓度的溶液的步骤有:计算、称量、溶解(冷却)、转移、洗涤、定容、摇匀、装瓶贴签。配制硫酸溶液时,根据浓稀硫酸物质的量相等计算,浓硫酸的浓度可根据公式c=![]() 进行计算。
进行计算。
(1)用液体药品配制溶液需要的玻璃仪器有烧杯、量筒、胶体滴管、容量瓶、玻璃棒,因此一定不会用到的是A烧瓶和C分液漏斗;还需要的玻璃仪器是烧杯、玻璃棒。
(2)①配制溶液应根据体积选择合适的容量瓶以确保精度,然后根据容量瓶体积计算溶质的量,配制480mL 0.3 mol/L 的NaOH溶液需要选择500mL容量瓶,因此需要NaOH的物质的量为0.5L×0.3 mol/L=0.15mol,需要NaOH的质量为:m=nM=0.15mol/L×40g/mol =6.0g,因此需要称取6.0NaOH固体。
②NaOH溶液转移时洒落少许,会使溶质物质的量减小,配制的溶液浓度偏低。
(3)98%的浓硫酸的分数为: ![]() ,需要浓硫酸的体积为:
,需要浓硫酸的体积为:![]() 。
。
(4)A.用胶头滴管加水定容时俯视视刻度,读数比实际体积大,加入的水会低于刻度线,会使实际溶液浓度偏大,A错误;
B.容量瓶中有水不会影响配制溶液的浓度,B错误;
C.稀释硫酸的烧杯未洗涤可能会导致硫酸残余在烧杯中,会使配制的溶液浓度减小,C正确;
D.用胶头滴管加水定容时仰视刻度,读数比实际体积小,加入的水会超过刻度线,会使实际溶液浓度减小,D正确;
故选CD。


科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、Q、R 皆为前20号元素,其原子半径与化合价的关系如图所示。下列说法错误的是

A.QX 中只存在离子键
B.简单离子半径:r(M-)>r(Q+)>r(R2+)
C.X、Y、Z 三种元素组成的化合物可能是盐或碱
D.ZM3 各原子最外层电子数均满足8 电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有含Fe(NO3)3、Cu(NO3)2、HNO3的某稀溶液,若向其中逐步加入铁粉,溶液中Fe2+浓度与加入铁粉的物质的量之间的关系如右图所示,则该溶液中Fe(NO3)3、Cu(NO3)2、HNO3物质的量浓度之比为( )

A. 1∶1∶3B. 1∶2∶4C. 1∶1∶4D. 1∶3∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下列图象的说法正确的是( )
A. 表示的反应速率随温度变化的关系可知该反应的△H>0

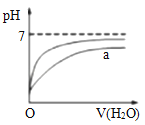
B. 表示向pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,则其中曲线a对应的是醋酸
C. 表示该反应为放热反应,且催化剂能降低反应的活化能、改变反应的焓变

D. 中开关K置于a或b处均可减缓铁的腐蚀

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】爱国实业家侯德榜在氨碱法的基础上,发明了“联合制碱法”,简单流程如图。完成下列问题:

(1)在饱和食盐水中通入X和Y,则X____(填物质名称)
(2)写出通入X和Y的化学反应方程式_____。
(3)操作Z____(填名称),为了得到化肥(NH4Cl),需要在溶液B中通入NH3、加食盐,其中通入NH3的作用一____,作用二____。
(4)工业生产的纯碱常会含少量NaCl杂质。现用重量法测定其纯度,步骤如下:①称取样品ag,加水溶解;②加入足量的BaCl2溶液;③过滤、___、烘干、冷却、称量、烘干、冷却、___,最终得到固体bg。样品中纯碱的质量分数为____(用含a、b的代数式)
(5)某课外活动小组要用NaOH溶液和CO2来制备Na2CO3固体,他们只有未知浓度的NaOH溶液50毫升和足量的CO2,他们的设计方案是:首先_____,然后_____,加热_____后,再____,最后加热浓缩,冷却结晶,过滤得固体Na2CO3 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2SO2(g)+O2(g)=2SO3(g) △H,有关数据如下:

下列说法不正确的是( )
A.根据平衡常数随温度的变化关系,判断出△H<0
B.保持其他条件不变,SO2的平衡转化率a(727℃)<a(927℃)
C.增大压强、降低温度能提高SO2的转化率
D.SO3的稳定性随温度的升高而降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,利用CO2合成CH3OH的反应如下: CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H1,研究发现,反应过程中会有副反应:CO2(g)+H2(g)
CH3OH(g)+H2O(g) △H1,研究发现,反应过程中会有副反应:CO2(g)+H2(g)![]() CO(g)+H2O(g) △H2。温度对CH3OH、CO的产率影响如图所示.下列说法中,不正确的是( )
CO(g)+H2O(g) △H2。温度对CH3OH、CO的产率影响如图所示.下列说法中,不正确的是( )

A. △H1<0,△H2>0
B. 增大压强有利于加快合成反应的速率
C. 生产过程中,温度越高越有利于提高CH3OH的产率
D. 合成CH3OH反应的平衡常数表达式是K=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列各组离子在指定溶液中能大量共存的是
A. ![]() =1×10-12的溶液:Na+、K+、ClO-、CO32-
=1×10-12的溶液:Na+、K+、ClO-、CO32-
B. 滴入酚酞变红色的溶液:K+、Ca2+、HCO3-、CO32-
C. 能溶解Al(OH)3的溶液:K+、NH4+、NO3—、CH3COO—
D. 0.1mol/LFe(NO3)2溶液:H+、Cu2+、SO42—、Cl—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、在火箭推进器中装有强还原剂肼(N2H4)和强氧化剂(H2O2),当它们混合时,即产生大量![]() N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256kJ的热量.
N2和水蒸气,并放出大量热.已知0.4mol液态肼和足量液态H2O2反应,生成氮气和水蒸气,放出256kJ的热量.
(1)写出该反应的热化学方程式_______________________________________.
(2)已知H2O(l)═H2O(g);△H=+44kJ·mol﹣1,则16g液态肼燃烧生成氮气和液态水时,放出的热量是________kJ.
(3)丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=﹣a kJ·mol﹣1
途径II:C3H8(g)═C3H6(g)+H2(g)△H=+b kJ·mol﹣1
2C3H6(g)+9O2(g)═6CO2(g)+6H2O(l)△H=﹣c kJ·mol﹣1
2H2(g)+O2 (g)═2H2O(l)△H=﹣d kJ·mol﹣1 (abcd均为正值)
请回答下列问题:
①判断等量的丙烷通过两种途径放出的热量,途径I放出的热量_______(填“大于”、“等于”或“小于”)途径II放出的热量.
②在C3H8(g)═C3H6(g)+H2(g) 的反应中,反应物具有的总能量________(填“大于”、“等于”或“小于”)生成物具有的总能量.
③b 与a、c、d的数学关系式是_____________.
II、利用如图所示装置测定中和热的实验步骤如下:

①用量筒量取50 mL 0.50 mol·L1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 mol·L1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液最高温度。
回答下列问题:
(1)为什么所用NaOH溶液要稍过量?__________________________。
(2)假设盐酸和氢氧化钠溶液的密度都是1 g·cm3,又知中和反应后生成溶液的比热容c=4.18 J·g1·℃1。为了计算中和热,某学生实验记录数据如下:
实验 序号 | 起始温度t1/℃ | 终止温度t2/℃ | |
盐酸 | 氢氧化钠 | ||
1 | 20.0 | 20.0 | 23.0 |
2 | 20.1 | 20.1 | 23.2 |
3 | 20.2 | 20.2 | 23.4 |
依据该学生的实验数据计算,该实验测得的中和热ΔH=________kJ·mol1_(结果保留一位小数)。
(3)不能用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com