
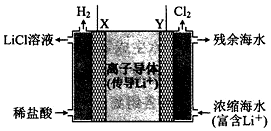
 浓差电池中的电动势是由于电池中存在浓度差而产生的.某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能.下列有关该电池的说法错误的是( )
浓差电池中的电动势是由于电池中存在浓度差而产生的.某浓差电池的原理如图所示,该电池从浓缩海水中提取LiCl的同时又获得了电能.下列有关该电池的说法错误的是( )| A. | 电池工作时,Li+通过离子电子导体移向b区 | |
| B. | 电流由X极通过外电路移向Y极 | |
| C. | 正极发生的反应为:2H++2e-=H2↑ | |
| D. | Y极每生成1 mol Cl2,a区得到2 mol LiCl |
分析 加入稀盐酸,在X极上生成氢气,发生还原反应,电极方程式为2H++2e-═H2↑,为正极反应,Y极生成Cl2,为负极反应,发生Cl--2e-=Cl2↑,以此解答该题.
解答 解:A.电池工作时,Li+向正极移动,故A错误;
B.在X极上生成氢气发生还原反应,为正极,生成氯气的Y极发生氧化反应,为负极,电流由X极通过外电路移向Y极,故B正确;
C.在X极上生成氢气,发生还原反应,电极方程式为2H++2e-═H2↑,故C正确;
D.Y极每生成1 mol Cl2,则转移2mol电子,有2molLi+向正极移动,则a区得到2 mol LiCl,故D正确.
故选A.
点评 本题考查原电池的工作原理,注意根据总反应式结合物质所含元素化合价的变化判断原电池的正负极,把握电极方程式的书写方法,易错点为C,注意浓差电池与一般原电池的区别,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L | B. | 0.2 mol/L | C. | 0.3 mo/L | D. | 0.4 mo/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(N2):c(H2):c(NH3)=1:3:2 | |
| B. | 2v(H2)=3v(NH3) | |
| C. | 单位时间内1个N≡N键断裂的同时,有6个N-H键断裂 | |
| D. | 单位时间消耗0.1molN2的同时,生成0.2molNH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
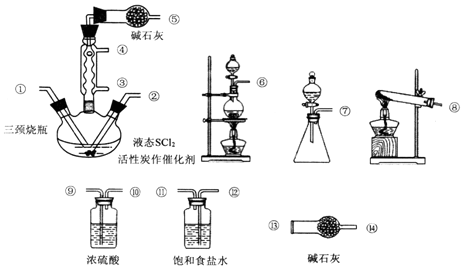
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 已知:
已知:| A. | 反应①使用催化剂,△H1减小 | |
| B. | 反应②生成物总能量低于反应物总能量 | |
| C. | 反应③一定能自发进行 | |
| D. | 反应③达到平衡后升高温度,v(正)、v(逆)的变化如图所示 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 2 | C | N | O | |||||
| 3 | Na | Mg | Si | S | Cl | Ar | ||
| 4 | Ca |
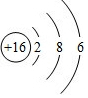 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com