
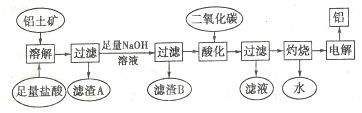
分析 铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,加入足量的盐酸,能溶解除SiO2外的其余氧化物,则过滤后滤渣为不溶于稀盐酸的SiO2,滤液中加入足量的NaOH溶液,除中和过量的盐酸外,还将溶液中的Al3+先沉淀后溶解最终生成NaAlO2,同时沉淀溶液中的Fe3+、Mg2+为Fe(OH)3、Mg(OH)2,则过滤所得滤渣B为沉淀Fe(OH)3、Mg(OH)2;滤液用二氧化碳酸化时,将NaAlO2完全转化为Al(OH)3,反应的离子方程式为:AlO2-+2H2O+CO2═HCO3-+Al(OH)3↓;过滤得氢氧化铝沉淀,灼烧得氧化铝,电解氧化铝得单质铝,以此解答该题;
I、(1)根据土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,加入盐酸后过滤所得滤渣应为不溶于稀盐酸的氧化物;
(2)加入盐酸过滤后所得溶液中存在H+、Al3+、Mg2+、Fe3+,加入的NaOH均能与之发生离子反应,且过量的NaOH还能溶解Al(OH)3,据此判断发生的离子反应,同时写出溶解沉淀的离子方程式;
(3)滤液用二氧化碳酸化时,将NaAlO2完全转化为Al(OH)3,根据电荷守恒和原子守恒,写出此反应的离子方程式;
(4)电解氧化铝时发生氧化还原反应,遵守电子守恒,其中Al从+3价还原为0价,生成1mol氧气转化4mol电子,据此分析生成氧气的质量;
Ⅱ、(1)该方案能测得质量分数的成分为二氧化硅、氧化铝,结合质量关系计算得到;
(2)洗涤固体A的洗涤液中含有其他杂质离子,检验固体A洗涤是否干净,设计实验检验是否含有铁离子检验.
解答 解:铝土矿的主要成分是Al2O3,此外还含有少量SiO2、Fe2O3等杂质,加入足量的盐酸,能溶解除SiO2外的其余氧化物,则过滤后滤渣为不溶于稀盐酸的SiO2,滤液中加入足量的NaOH溶液,除中和过量的盐酸外,还将溶液中的Al3+先沉淀后溶解最终生成NaAlO2,同时沉淀溶液中的Fe3+、Mg2+为Fe(OH)3、Mg(OH)2,则过滤所得滤渣B为沉淀Fe(OH)3、Mg(OH)2;滤液用二氧化碳酸化时,将NaAlO2完全转化为Al(OH)3,反应的离子方程式为:AlO2-+2H2O+CO2═HCO3-+Al(OH)3↓;过滤得氢氧化铝沉淀,灼烧得氧化铝,电解氧化铝得单质铝;
I、(1)铝土矿中加入足量的盐酸,能溶解除SiO2外的其余氧化物Al2O3、MgO、Fe2O3等,则过滤后滤渣为不溶于稀盐酸的SiO2,故答案为:SiO2;
(2)滤液中加入足量的NaOH溶液,除中和过量的盐酸外,还将溶液中的Al3+先沉淀后溶解最终生成NaAlO2,同时沉淀溶液中的Fe3+、Mg2+为Fe(OH)3、Mg(OH)2,共发生了5个离子反应,其中溶解发生的离子反应为:OH-+Al(OH)3=AlO2-+2H2O,
故答案为:5;OH-+Al(OH)3=AlO2-+2H2O;
(3)向含有NaAlO2通入CO2气体生成Al(OH)3,反应的离子方程式为:AlO2-+2H2O+CO2═HCO3-+Al(OH)3↓,
故答案为:AlO2-+2H2O+CO2═HCO3-+Al(OH)3↓;
(4)电解氧化铝,每生成1molA1时转移电子的物质的量为3mol,根据电子守恒同时生成氧气的物质的量为$\frac{3mol}{4}$=0.75mol,则氧气的质量为0.75mol×32g/mol=24g,故答案为:24;
Ⅱ、(1)该方案能测得质量分数的成分为二氧化硅、氧化铝,结合质量关系计算得到,流程中m1为二氧化硅的质量,质量分数=$\frac{{m}_{1}}{m}$×100%,得到固体质量m2g为Fe2O3、MgO的质量,所以氧化铝的质量=m=m1-m2,氧化铝质量分数=$\frac{m{-m}_{1}-{m}_{2}}{m}$×100%,
故答案为:SiO2:$\frac{{m}_{1}}{m}$×100%、Al2O3:$\frac{m{-m}_{1}-{m}_{2}}{m}$×100%;
(2)洗涤固体A的洗涤液中含有其他杂质离子Al3+、Fe3+、Mg2+,洗涤固体A后的洗涤液是需加入到滤液A中,减少损失,检验固体A洗涤是否干净,设计实验检验是否含有铁离子检验,取最后一次洗涤液与少许试管中,滴入几滴KSCN溶液,溶液不变红,说明洗涤干净;
故答案为:是;取最后一次洗涤液与少许试管中,滴入几滴KSCN溶液,溶液不变红,说明洗涤干净.
点评 本题考查Al及其化合物的化学性质、物质分离提纯方法和基本操作的综合应用,注意把握流程中发生的化学反应为解答的关键,注重信息与所学知识的结合分析解决问题,侧重知识迁移应用能力的考查,题目难度中等.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 阿司匹林是常用的抗酸药 | |
| B. | 铵态氮肥常与碱性物质如草木灰等混合施用 | |
| C. | 生石灰主要成分是酸性化合物 | |
| D. | 从海水中可提取溴 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
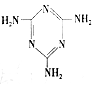 )俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸(
)俗称“蛋白精”.动物摄入三聚氰胺和三聚氰酸( 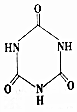 )
)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 等体积pH=2的HX和HY两种酸分别与足量的铁反应,用排水法收集气体 | HX放出的氢气多且反应速率快 | HX酸性比HY强 |
| B | 向某溶液中滴入氯化钡溶液和稀硝酸 | 生成白色沉淀 | 说明原溶液含Ba2+ |
| C | 在稀硫酸中加入铜,再加入硝酸钠固体 | 开始无现象,后铜逐步溶解,溶液变蓝,有气泡产生 | 硝酸钠可以加快铜与稀硫酸的反应速率 |
| D | 将一铝箔放在酒精灯外焰上灼烧 | 铝箔熔化但不滴落 | 铝箔表面生成致密的Al2O3薄膜,且Al2O3熔点高于Al |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热条件下足量的铜粉与含0.2 mol H2SO4的浓硫酸充分反应,转移电子数目为0.2 NA | |
| B. | 0.1 mol CaO2中含有的阴、阳离子总数为0.2 NA | |
| C. | 1.6 g CH4中含有的C-H键数目为0.4 NA | |
| D. | 标准状况下,2.24 L H37Cl含有的中子数为2.0 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
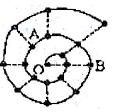 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“•”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A. | A、B组成的化合物中不可能含有共价键 | |
| B. | 虚线相连的元素处于同一族 | |
| C. | B元素是图中金属性最强的元素 | |
| D. | 离O点越远的元素原子半径越大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫能使高锰酸钾酸性溶液迅速褪色 | |
| B. | 可以用澄清石灰水鉴别二氧化硫和二氧化碳 | |
| C. | 硫粉在过量的纯氧中燃烧可以生成三氧化硫 | |
| D. | 少量二氧化硫通入浓的氯化钙溶液中能生成白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| B. | 用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗盐酸的体积大 | |
| C. | 一定温度下,反应2Mg(S)+CO2(g)=2MgO(S)+C(s)能自发进行,则该反应△H<0 | |
| D. | 常温时,0.1mol•L-l CHCOOH 溶液加水稀释,$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$的值不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 有机物 A 是一种纯净的无色黏稠液体,易溶于水.为研究 A 的组成与结构,进行了如下实验,实验步骤:
有机物 A 是一种纯净的无色黏稠液体,易溶于水.为研究 A 的组成与结构,进行了如下实验,实验步骤: .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com