
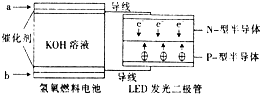
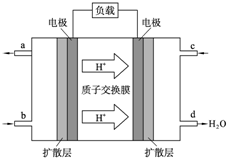
 LED产品的使用为城市增添色彩.图是氢氧燃料电池驱动LED发光的一种装置示意图.下列有关叙述正确的是( )
LED产品的使用为城市增添色彩.图是氢氧燃料电池驱动LED发光的一种装置示意图.下列有关叙述正确的是( )| A. | P-型半导体连接的是电池负极 | |
| B. | b处为电池正极,发生了还原反应 | |
| C. | a处通入氢气,发生还原反应 | |
| D. | 该装置中只涉及两种形式的能量转化 |
分析 A.根据电子流向可知P一型半导体连接的是电池正极;
B.根据电子流向可知,a为负极,b为正极;
C.氢气在负极失电子发生氧化反应;
D、该装置的能量转换有化学能、电能和光能等.
解答 解:A.电子从负极流向阴极,由阴极流向阳极,所以P一型半导体为阳极,连接的是电池正极,故A错误;
B.由电子流向可知a为负极,b为正极,正极上氧气得电子,发生了还原反应,故B正确;
C.a为负极,氢气在负极失电子发生氧化反应,故C错误;
D、该装置的能量转换有化学能、电能和光能,所以该装置中涉及多种形式的能量转化,故D错误.
故选B.
点评 本题考查原电池知识,题目难度不大,本题注意根据图示电子的流向判断电源的正负极为解答该题的关键,侧重于考查学生对基础知识的应用能力.


 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案科目:高中化学 来源: 题型:解答题
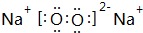 (写一种);
(写一种);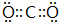 (写一种).
(写一种).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
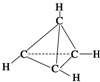 一种有机物的分子式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代物的种类共有( )
一种有机物的分子式为C4H4,分子结构如图所示,将该有机物与适量氯气混合后光照,生成的氯代物的种类共有( )| A. | 2 种 | B. | 4种 | C. | 5种 | D. | 6种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③④ | C. | ①③④⑤ | D. | ②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 人们应用原电池原理制作了多种电池以满足不同的需要.电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、电脑、照相机等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染.请根据题中提供的信息,回答下列问题:
人们应用原电池原理制作了多种电池以满足不同的需要.电池发挥着越来越重要的作用,如在宇宙飞船、人造卫星、电脑、照相机等,都离不开各式各样的电池,同时废弃的电池随便丢弃也会对环境造成污染.请根据题中提供的信息,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径的大小顺序为:r(R2-)>r(X+)>r(Y2-) | |
| B. | 最高价氧化物对应水化物的酸性强弱顺序是:R>W>Z | |
| C. | Y与X形成的化合物和Y与W形成的化合物化学键类型完全相同 | |
| D. | 分别向BaCl2溶液中通入RY2、WY2,均有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | X | Y | Z | L | M | Q |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.112 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | +2 | -2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于白磷和红磷都是由P元素构成的且结构不同,故白磷和红磷互称为同分异构体 | |
| B. | H2O和D2O是同素异形体 | |
| C. | CH3-CH2-CH2-CH3和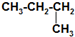 互称为同分异构体 互称为同分异构体 | |
| D. | 石英晶体是一个空间网状结构,石英晶体中不存在单个分子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com