
下列反应的离子方程式中,正确的是( )
A.Na2CO3溶液与Ba(OH)2溶液反应:
CO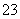 +Ba2+===BaCO3↓
+Ba2+===BaCO3↓
B.NaOH溶液与Ca(HCO3)2溶液反应:
HCO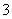 +OH-===CO
+OH-===CO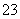 +H2O
+H2O
C.NaHCO3溶液与盐酸反应:
CO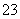 +2H+===CO2↑+H2O
+2H+===CO2↑+H2O
D.NaHCO3溶液与CaCl2溶液反应:
CO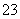 +Ca2+===CaCO3↓
+Ca2+===CaCO3↓
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
已知溶液中存在下列离子,试判断该溶液的溶质并写出其电离方程式:
(1)H+、Cl-__________________________________________。
(2)Fe3+、SO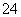 _____________________________________________。
_____________________________________________。
(3)Na+、HCO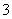 __________________________________________________。
__________________________________________________。
(4)NH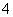 、NO
、NO _______________________________________________。
_______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在含有FeCl3和BaCl2的强酸性溶液中通入足量的SO2有白色沉淀生成。由此得出的结论是( )
①白色沉淀是BaSO4 ②白色沉淀是BaSO3
③白色沉淀是BaSO3和BaSO4的混合物
④FeCl3被SO2还原为FeCl2
A.①③ B.②④ C.②③ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
“活化分子”是衡量化学反应速率快慢的重要依据,下列有关说法不正确的是
A.能够发生有效碰撞的分子一定是活化分子
B.增大浓度,单位体积内活化分子数增加,化学反应速率增大
C.加入反应物,使活化分子百分数增大,化学反应速率增大
D.一般使用催化剂可以降低反应的活化能,增大活化分子百分数,增大化学反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
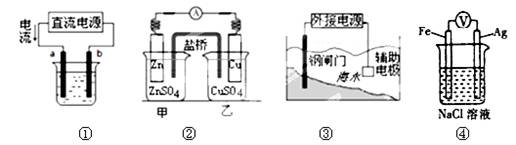
关于下列各装置图的叙述不正确的是
A.用图①装置精炼铜,a极为粗铜,b为精铜,电解质溶液为CuSO4溶液
B.图②装置的盐桥中KCl的Cl—移向甲烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护
D.装置④中Ag电极发生反应:2H2O + 2e- = H2↑+ 2OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
如图是以铅蓄电池为电源,模拟氯碱工业电解饱和食盐水的装置图(C、D均为石墨电极)。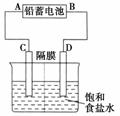 已知:铅蓄电池在放电时发生下列电极反应:负极Pb+SO
已知:铅蓄电池在放电时发生下列电极反应:负极Pb+SO -2e-===PbSO4
-2e-===PbSO4
正极PbO2+4H++SO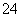 +2e-===PbSO4+2H2O
+2e-===PbSO4+2H2O
(1)请写出电解饱和食盐水的化学方程式__ ▲ __ 。
(2)若在电解池中C极一侧滴酚酞试液,电解一段时间后未呈红色,说明铅蓄电池的A极为 ▲ __极。
(3)用铅蓄电池电解1L饱和食盐水(食盐水足量、密度为1. 15 g/cm3)时,
①若铅蓄电池消耗H2SO42mol,则可收集到H2的体积(标准状况下)为 ▲ __ L。
②若消耗硫酸amol,电解后除去隔膜,所得溶液中NaOH的质量分数表达式为(假设氯气全部排出) ▲ __ (用含a的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
在氧化还原反应中,下列叙述正确的是 ( )
A. 物质失电子的反应为氧化反应
B. 物质在变化中失去电子,此物质是氧化剂
C. 发生电子转移的反应即是氧化还原反应
D. 发生化合价升降的反应不一定是氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com