
| A、2ml | B、3ml |
| C、4ml | D、5ml |
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:
| A、c(NH4+)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl) |
| B、等物质的量的NaClO、NaHCO3混合溶液:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
| C、向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
| D、某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH-)+c(HA-)+c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、烧杯中的溶液呈棕黄色 |
| B、铜片无任何变化 |
| C、铜片上有凹陷的“Cu”字 |
| D、发生了反应:Fe3++Cu=Cu2++Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将稀氨水逐滴加入稀硫酸中,当溶液pH=7时,c(SO42-)>c(NH4+) |
| B、两种醋酸溶液的物质的量浓度分别c1和c2,pH分别为a和a+1,则c1=10c2 |
| C、常温下物质的量浓度相等的①(NH4)2CO3、②NH4HSO4、③(NH4)2Fe(SO4)2三种溶液中c(NH4+):③>①>② |
| D、pH=5的硫酸溶液稀释到原来的500倍,稀释后溶液中c(SO42-)与c(H+)之比约为1:10 |
查看答案和解析>>
科目:高中化学 来源: 题型:
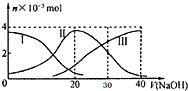 25℃时,向20mL 0.2mol/L H2A(某二元弱酸)溶液中滴加0.2mol/L NaOH溶液,有关微粒的物质的量变化如图(其中I代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)?根据图示判断,下列说法中正确的是( )
25℃时,向20mL 0.2mol/L H2A(某二元弱酸)溶液中滴加0.2mol/L NaOH溶液,有关微粒的物质的量变化如图(其中I代表H2A,Ⅱ代表HA-,Ⅲ代表A2-)?根据图示判断,下列说法中正确的是( )| A、当V(NaOH)=20mL时,所得溶液中:c(OH-)>c(H+) |
| B、当V(NaOH)=30mL时,所得溶液中:2c(H+)+c(HA-)+3c(H2A)=c(A2-)+2 c(OH-) |
| C、当V(NaOH)=40mL时,所得溶液中:c(Na+)>c(A2-)>c(H+)>c(HA-)>c(OH-) |
| D、在NaHA溶液中:c(OH-)+2c(A2-)=c(H+)+2c(H2A) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向碳酸钠溶液中滴加少量醋酸:2CH3COOH+CO32-═2CH3COO-+CO2↑+H2O |
| B、向次氯酸钠溶液中通入少量CO2:2ClO-+H2O+CO2═2HClO+CO32- |
| C、向醋酸清洗水垢后氢氧化镁:2CH3COOH+Mg(OH)2═Mg2++2CH3COO-+2H2O |
| D、向漂白粉溶液中通入少量的SO2:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、晶体硅熔点高硬度大,可用于制作半导体材料 |
| B、氧化铁能与酸反应,可用于制作红色涂料 |
| C、漂白粉在空气中不稳定,可用于漂白纸张 |
| D、氢氧化铝具有弱碱性,可用于制胃酸中和剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
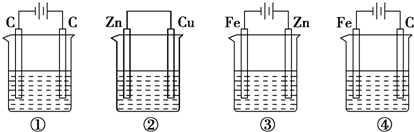
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com