
【题目】氯苯在染料、医药工业中用于制造苯酚、硝基氯苯、苯胺、硝基酚等有机中间体。实验室中制备氯苯的装置如下图所示(其中夹持仪器及加热装置略去)。
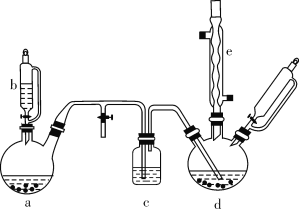
请回答下列问题:
(1)仪器b的名称是____。仪器a中盛有KMnO4晶体,仪器b盛有浓盐酸。打开仪器b的活塞,使浓盐酸缓缓滴下,可观察到仪器a内的现象是___,用离子方程式表示产生该现象的原因: __。
(2)仪器d内盛有苯、FeCl3粉末固体,仪器a中生成的气体经过仪器c进入仪器d中。仪器d中的反应进行过程中,保持温度在40~60 ℃,以减少副反应发生。仪器d的加热方式最好是___加热,其优点是__。
(3)该方法制备的氯苯中含有很多杂质,工业生产中,通过水洗除去FeCl3、HCl及部分Cl2,然后通过碱洗除去Cl2。碱洗后通过分液得到含氯苯的有机混合物,混合物成分及沸点如下表所示:
有机物 | 苯 | 氯苯 | 邻二氯苯 | 间二氯苯 | 对二氯苯 |
沸点/℃ | 80 | 132.2 | 180.4 | 173.0 | 174.1 |
从该有机混合物中提取氯苯时,采用蒸馏的方法,收集____℃左右的馏分。
(4)实际工业生产中,苯的流失如下表所示:
流失项目 | 蒸气挥发 | 二氯苯 | 其他 | 合计 |
苯流失量(kg/t) | 28.8 | 14.5 | 56.7 | 100 |
某一次投产加入13 t苯,则制得氯苯____t(保留一位小数)。
【答案】滴液漏斗(或恒压分液漏斗)有黄绿色气体生成2MnO4-+10Cl-+16H+===2Mn2++5Cl2↑+8H2O水浴受热均匀,易于控制温度132.216.9
【解析】
(1)根据装置图可知,仪器b的名称是滴液漏斗或恒压分液漏斗;仪器a中盛有KMnO4晶体,仪器b盛有浓盐酸。利用高锰酸钾的强氧化性,能将氯离子氧化为氯气,发生反应2KMnO4+16HCl(浓)===2MnCl2+5Cl2↑+8H2O,可观察到仪器a内的现象是有黄绿色气体生成,反应的离子方程式为:2MnO4-+10Cl-+16H+===2Mn2++5Cl2↑+8H2O;(2)仪器d中的反应进行过程中,保持温度在40~60 ℃,以减少副反应发生。仪器d的加热方式最好是水浴加热,其优点是受热均匀,易于控制温度;(3)实验室制备氯苯,根据混合物沸点数据,因此收集132.2℃左右的馏分;(4)1 t损失苯100kg,则13 t苯损失苯![]() ,有(13-1.3)t苯生成氯苯,因此氯苯的质量为(13-1.3)
,有(13-1.3)t苯生成氯苯,因此氯苯的质量为(13-1.3)![]() t=16.9t。
t=16.9t。


 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】某溶液由Na+、Cu2+、Ba2+、Fe3+、AlO2-、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:下列说法正确的是( )
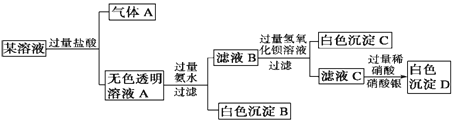
A. 原溶液中一定只存在AlO2-、CO32-、SO42-、Cl- 四种离子
B. 气体A的化学式是CO2,其电子式为O::C::O
C. 原溶液中一定不存在的离子是Cu2+、Ba2+、Fe3+
D. 生成沉淀B的离子方程式为:Al3++ 3OH- = Al(OH)3 ↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是周期表中短周期的一部分,A、B、C三种元素的原子核外电子数之和等于B的质量数,B元素的原子核内质子数等于中子数,下列叙述正确的是( )
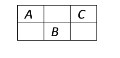
A. B为第二周期的元素
B. C为VA族元素
C. 三种元素都为非金属元素
D. B是三者中化学性质最活泼的非金属
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁为中学常见物质,其中甲、乙为单质,丙为氧化物,它们之间存在如图所示的转化关系:
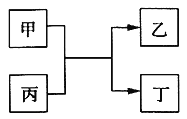
下列说法正确的是( )
A. 若甲、乙元素是同主族元素,根据元素周期表推测,此时乙单质可能是Si
B. 若甲、乙均为金属单质,则丁所属的物质类别一定是碱性氧化物
C. 若甲为金属单质,乙为非金属单质,则甲只能是Mg
D. 若甲、乙元素是同周期元素,则该反应的化学方程式一定为:2F2 + 2H2O=4HF + O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑩中元素,用元素符号或化学式填空回答以下问题:
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
四 | ⑨ | ⑩ |
(1)化学性质最不活泼的元素原子的原子结构示意图为________;
(2)比较元素①、②的简单氢化物的稳定性______________________(用化学式表示);
(3)元素的最高价氧化物对应的水化物中酸性最强的是________,碱性最强的是_______,呈两性的氢氧化物是_______________,(填写化学式) 元素③的最高价氧化物对应水化物中含有的化学键类型为________________;
(4)在③~⑦元素中,简单离子半径最小的是_________;
(5) Na2O2的电子式为___________;CO2的电子式为_________;
(6)在⑦与⑩的单质中,氧化性较强的是_______________,用化学反应方程式证明:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年科幻片《流浪地球》中有个画面,冰原上是身穿“核电池全密封加热服”的人类,一旦被卸下核电池,人类就被冻僵,该装置提供电能,并将电能转化为 ( )
A.化学能B.热能C.生物质能D.动能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物X的合成路线如下图所示。请回答下列问题:
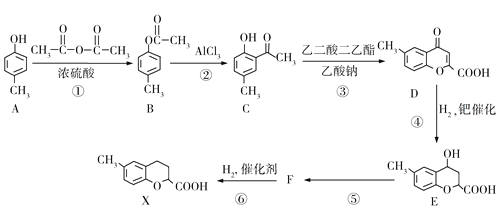
(1)A的名称是________________,X的分子式为_____________。
(2)B的核磁共振氢谱中所有峰的面积之比是________________。
(3)有机物D中含氧官能团的名称是________________,④的反应类型为________________。
(4)反应①的化学方程式为________________________________。
(5)有机物F的结构简式为________________________________。
(6)满足下列条件的C的同分异构体有_____种,任写出其中一种的结构简式_________。
①苯环上只有三个取代基;
②能与三氯化铁溶液反应显色;
③可以发生银镜反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素A、B、C、D的原子序数依次增大,B和D同主族;X、Y、N分别是由以上四种元素中两种组成的化合物,Z是由以上三种元素组成的化合物;若X与Y摩尔质量相同,Y为淡黄色固体,上述物质之间的转化关系如图所示(部分生成物省略),则下列说法中一定正确的是( )
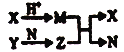
A. 相对分子质量M>N,沸点M>N B. 简单离子半径:D>B>C>A
C. Z 为 Na2CO3 D. 图中有两个氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)辉铜矿(Cu2S)可发生反应:2Cu2S+2H2SO4+5O2===4CuSO4+2H2O,该反应的还原剂是________________。当1 mol O2发生反应时,还原剂所失电子的物质的量为_________mol。
(2)焙烧明矾的化学方程式为4KAl(SO4)2·12H2O+3S===2K2SO4+2Al2O3+9SO2+48H2O,在该反应中,还原剂是_____________。
(3)KClO3可用于实验室制O2,若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1∶1。写出该反应的化学方程式:________________________。
(4)实验室从含碘废液(除H2O外,含有CCl4、I2、I-等)中回收碘,其实验过程如下:
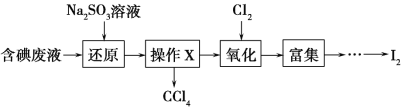
向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为_________________;该操作将I2还原为I-的目的是________________________。
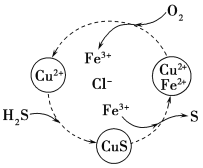
(5)将H2S和空气的混合气体通入FeCl3、FeCl2、CuCl2的混合溶液中反应回收S,其物质转化如图所示。在图示的转化中,化合价不变的元素是________________。
(6)NaBH4是一种重要的储氢载体,能与水反应得到NaBO2,且反应前后B的化合价不变,该反应的化学方程式为________________,反应消耗1 mol NaBH4时转移的电子数目为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com