


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:013
在已经平衡的天平的两边托盘上各放一个相同质量的烧杯,再注入0.5mol/L的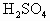 各20mL,向左盘的烧杯中加入10g的Zn,为了保持天平的平衡,应当向右盘的烧杯中放入铁的质量是
各20mL,向左盘的烧杯中加入10g的Zn,为了保持天平的平衡,应当向右盘的烧杯中放入铁的质量是
[ ]
查看答案和解析>>
科目:高中化学 来源:高中化学同步单元练习册第一册(高一年级) 题型:013
在已经平衡的天平的两边托盘上各放一个相同质量的烧杯,再注入0.5mol/L的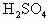 各20mL,向左盘的烧杯中加入10g的Zn,为了保持天平的平衡,应当向右盘的烧杯中放入铁的质量是
各20mL,向左盘的烧杯中加入10g的Zn,为了保持天平的平衡,应当向右盘的烧杯中放入铁的质量是
[ ]
查看答案和解析>>
科目:高中化学 来源:高中化学习题 题型:022
在已平衡的天平的两个托盘上各放一个等质量的烧杯,分别加入含36.5g(![]() )的盐酸溶液,再向左盘加入
)的盐酸溶液,再向左盘加入![]() ,向右盘加入
,向右盘加入![]() 固体,要使天平仍然保持平衡,试写出下列情况中
固体,要使天平仍然保持平衡,试写出下列情况中![]() 与
与![]() 的关系式:
的关系式:
(1)当![]() 时________;
时________;
(2)当![]() ,
,![]() 时________;
时________;
(3)当![]() ,
,![]() 时________.
时________.
当![]() 时,天平是否可能保持平衡________(能与不能),原因是________.
时,天平是否可能保持平衡________(能与不能),原因是________.
查看答案和解析>>
科目:高中化学 来源:物理教研室 题型:038
(1)若A为NaHCO3
①当a≤15时,x的值为________;(用含a的代数式表示,以下同)
②当25.2≥a>15时,x的值为________;
③当a>25.2时,x的值为________.
(2)若A为KHCO3,且两只烧杯中均无固体物质存在,则x取值必须满足的条件是________.
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学为测定某烧碱样品中含NaOH的纯度(设样品中杂质为NaCl),进行如下实验:
(1)称取样品:调节托盘天平到零点后,在天平两盘放质量大小相同纸片,使天平保持平衡,向左盘放一个5g砝码,将游码拨0.2g处;向右盘纸片上缓缓小心加烧碱颗粒到天平达平衡。该操作的错误之处有: 。按如上操作,该同学称取烧碱样品的实际量应是 。
(2)配制溶液:将纸片上的烧碱样品小心移入100mL容量瓶中,加蒸馏水到刻度,盖紧瓶塞,反复倒置摇匀,该操作的错误是 。按此方法所配制得的溶液浓度应 (从“偏高”或“偏低”等词中选填)
(3)取液:将用蒸馏水洗净的锥形瓶再用所配制碱液润洗2~3次,再用蒸馏水洗净的移液管取10mL所配碱液移入锥形瓶,再向瓶中加入约15mL蒸馏水将碱液稀释。此操作中错误之处是 。
(4)滴定:向锥形瓶中加入约2mL酚酞溶液,用浓度为0.5mol?L-1的盐酸标准液进行滴定,滴定时左手操作滴定管,右手猛力振荡锥形瓶,当锥形瓶中溶液颜色刚变粉红色时,停止滴定,记下耗酸体积数,此步操作中错误之处是 。
将(3)(4)操作重复一次
(5)计算:取两次操作耗标准酸液体积平均值为20.00mL,依此数据计算出烧碱样品中含NaOH的质量分数为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com