
| ||
| ||


科目:高中化学 来源: 题型:
| A、K2S和稀H2SO4 |
| B、K2SO3和盐酸 |
| C、K2S和盐酸 |
| D、K2SO3和稀H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeCl3 |
| B、CaCl2 |
| C、ZnCl2 |
| D、BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 足量稀HCl |
| BaCl2溶液 |
| 足量稀HCl |
| BaCl2溶液 |
| Ba(NO3)2溶液 |
| 足量稀HNO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:

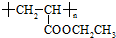 可用于制备涂料,其单体结构简式为
可用于制备涂料,其单体结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
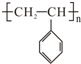 ,试回答下列问题:
,试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
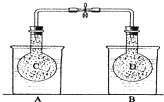 如图所示,在25℃时,在烧杯A中装有50.0mL水,烧杯B中装有0.50mol/L盐酸50.0mL,把NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把C烧瓶放入A烧杯中,D烧瓶放入B烧瓶中.然后往A烧杯中加入50.0g NH4NO3粉末搅拌使其完全溶解,往B烧杯中加入2.0g NaOH固体搅拌并使其溶解后,回答下列问题:
如图所示,在25℃时,在烧杯A中装有50.0mL水,烧杯B中装有0.50mol/L盐酸50.0mL,把NO2和N2O4的混合气体盛在两个连通的烧瓶C、D里,然后用夹子夹住橡皮管,把C烧瓶放入A烧杯中,D烧瓶放入B烧瓶中.然后往A烧杯中加入50.0g NH4NO3粉末搅拌使其完全溶解,往B烧杯中加入2.0g NaOH固体搅拌并使其溶解后,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、放入氧气中燃烧,检验燃烧产物都是CO2和H2O |
| B、放入银氨溶液中微热,都不发生银镜反应 |
| C、加入浓硫酸后微热,都脱水而变黑 |
| D、分别放入稀酸后煮沸几分钟,用NaOH溶液中和反应后的溶液,再加入新制的Cu(OH)2悬浊液共热,都生成红色沉淀 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com