
| A. | 密度大小:硝基苯>水>苯 | |
| B. | 熔、沸点高低:乙醇>丁烷>丙烷 | |
| C. | 含碳量大小:乙烷>乙醇>乙酸 | |
| D. | 等质量燃烧时的耗氧量:乙烷>乙烯>丙烯 |
分析 A、根据物质的物理性质分析;
B、含有氢键的物质熔沸点较高,分子晶体熔沸点与相对分子质量成正比;
C、乙烷、乙醇和乙酸中均含2个碳原子,但相对分子质量逐渐增大;
D、等质量的烃在燃烧时,H的百分含量越高,则耗氧量越大,据此分析.
解答 解:A、苯的密度小于1g/ml,水的密度等于1g/ml,硝基苯的密度大于1g/ml,所以密度:苯<水<硝基苯,故A正确;
B、含有氢键的物质熔沸点较高,分子晶体熔沸点与相对分子质量成正比,乙醇中含有氢键,熔沸点最高,丙烷相对分子质量大于乙烷且二者都是分子晶体,所以熔沸点:乙醇>丙烷>乙烷,故B正确;
C、乙烷、乙醇和乙酸中均含2个碳原子,但相对分子质量逐渐增大,故从乙烷到乙酸,碳的百分含量逐渐减小,故C正确;
D、等质量的烃在燃烧时,H的百分含量越高,则耗氧量越大,而三种物质中,H的百分含量的关系为乙烷>乙烯=丙烯,故等质量时的耗氧量乙烷>乙烯=丙烯,故D错误.
故选D.
点评 本题考查物质溶解度、熔沸点、密度大小比较,明确分子晶体熔沸点与溶解性的影响因素是解本题关键.


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:多选题
| A. | 铁粉与稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ | |
| B. | 钠与水反应:Na+H2O═Na++OH-+H2↑ | |
| C. | 二氧化碳通入澄清石灰水中CO2+Ca2++2OH-═CaCO3↓+H2O | |
| D. | 氢氧化钡溶液与盐酸混合OH-+H+═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
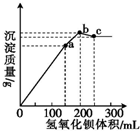 在100mL0.1mol•L-1铝铵矾[NH4Al(SO4)2•12H2O]的水溶液中,逐滴滴入0.1mol•L-1的Ba(OH)2溶液,所得沉淀的质量与Ba(OH)2溶液的体积曲线如图所示[已知Ba(AlO2)2易溶易电离].下列说法正确的是( )
在100mL0.1mol•L-1铝铵矾[NH4Al(SO4)2•12H2O]的水溶液中,逐滴滴入0.1mol•L-1的Ba(OH)2溶液,所得沉淀的质量与Ba(OH)2溶液的体积曲线如图所示[已知Ba(AlO2)2易溶易电离].下列说法正确的是( )| A. | a点溶液中大量存在的离子有NH4+和SO42- | |
| B. | b点溶液中c(NH3•H2O)约为0.1mol•L-1 | |
| C. | a→b过程中,反应的只有SO42- | |
| D. | b→c过程中,反应的是Al(OH)3和NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ②④⑤ | C. | ②③⑤ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
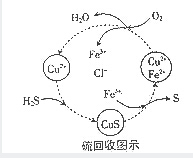 H2S、金属硫化物是硫的重要化合物.
H2S、金属硫化物是硫的重要化合物.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
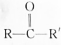 结构);B能与硝酸银的氨溶液作用生成白色沉淀,但C不与之反应.试推测A、B、C的构造式.
结构);B能与硝酸银的氨溶液作用生成白色沉淀,但C不与之反应.试推测A、B、C的构造式.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子氧比氧气化学性质活泼,二者互为同素异形体 | |
| B. | 银与银合金的薄膜材料化学性质活泼 | |
| C. | 原子氧和紫外光的辐照对二硫化钼润滑薄膜产品没有影响 | |
| D. | 二硫化钼润滑薄膜产品不适合用作航天器的润滑剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com