
| A�� | �����£�0.1 mol•L-1Na2S��Һ�д��ڣ�c��OH-��=c��H+��+c��HS-��+c��H2S�� | |
| B�� | pH=3�Ĵ�����Һ�У�c��H+��=c��CH3COO-��=3.0mol•L-1 | |
| C�� | ij��Һ����ˮ�������c��OH-��=1��10-amol•L-1����a��7ʱ�������Һ��pH����Ϊa | |
| D�� | �����£�pH=2��������pH=12�İ�ˮ�������ϣ�������Һ�У�c��Cl-����c��NH4+ ����c��H+����c��OH-�� |
���� A���κε������Һ�ж����������غ㣬���������غ��жϣ�
B���κε������Һ�ж����ڵ���غ㣬���ݵ���غ��жϣ�
C����������ˮ���룻
D�������£�pH=12�İ�ˮ��ҺŨ�ȴ���pH=2�����ᣬ�������Ϻ�ˮ��ʣ�࣬��Һ�ʼ��ԣ�
��� �⣺A���κε������Һ�ж����������غ㣬���������غ�֪��Na2S��Һ�д��ڣ�c��OH-��=c��H+��+c��HS-��+2 c��H2S������A����
B��pH=3�Ĵ�����Һ�У�c��H+��=10-3mol/L�����ݵ���غ��c��H+��=c��OH-��+c��CH3COO-��������c��H+����c��CH3COO-������B����
C��a��7ʱ��ˮ�ĵ��뱻���ƣ�����Ϊ�����ҺpHֵ������a��14-a����C��ȷ��
D��pH=2��������pH=12�İ�ˮ��������ʱ����ˮ������������Һ�У�c��NH4+ ����c��Cl-����c��OH-����c��H+������D����
��ѡC��
���� ���⿼������Ũ�ȴ�С�Ƚϣ�Ϊ��Ƶ���㣬��ȷ��Һ�����ʳɷּ��������ǽⱾ��ؼ���������Ũ�ȴ�С�Ƚ��г���Ӧ�õ���غ�������غ㣬֪����Щ��֮����������غ㣬���ؿ�������ж��������״�ѡ����C��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 1��3-������ϩ���������ȷ�Ӧ | |
| B�� | ��ȫȼ��ʱ1��3-������ϩ�ȱ����ȶ� | |
| C�� | ���������ɻ����������ȷ�Ӧ | |
| D�� | ����1��3-������ϩ�ȶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
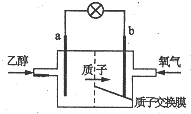 �����Ҵ�ȼ�ϵ�رȼ״�ȼ�ϵ�ص�Ч�ʸ߳�32�����Ҹ���ȫ����ṹ��ͼ��ʾ�����õ����������ܼ�����200������ʱ���磬��֪����ܷ�ӦʽΪ��C2H5OH+3O2=2CO2+3H2O������˵������ȷ���ǣ�������
�����Ҵ�ȼ�ϵ�رȼ״�ȼ�ϵ�ص�Ч�ʸ߳�32�����Ҹ���ȫ����ṹ��ͼ��ʾ�����õ����������ܼ�����200������ʱ���磬��֪����ܷ�ӦʽΪ��C2H5OH+3O2=2CO2+3H2O������˵������ȷ���ǣ�������| A�� | ��ع���ʱ������b���ص��߾����ݵ�a�� | |
| B�� | a��Ϊ��صĸ������õ缫����������Ӧ | |
| C�� | ��������ĵ缫��ӦʽΪO2+2H2O+4e-=4OH- | |
| D�� | ��ع���ʱ��23g�Ҵ�������ת�Ƶ���ʽΪ6mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ǵ�ˮ�⣨�Թܡ�������Һ�����Ƶ�Cu��OH��2����Һ�� | |
| B�� | ��NaOH����Һȷ��δ֪Ũ�ȵ�������Һ��ʯ����Һ����ʽ�ζ��ܡ���ƿ�� | |
| C�� | ֤�������д��ڵ�Ԫ�أ�©����ϡ���ᡢ�������������� | |
| D�� | �������������壨����FeCl3��Һ��NaOH��Һ����ͷ�ιܣ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
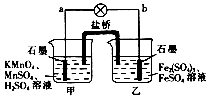
| A�� | b�缫�Ϸ�����ԭ��Ӧ | |
| B�� | ���ձ�����Һ��pH��С | |
| C�� | ��ع���ʱ�������е�SO42-������ձ� | |
| D�� | ���·�ĵ��������Ǵ�a��b |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��2minʱ��c��Fe2+��=0.01 mol•L-1 | |
| B�� | �����Һ�У�c��K+��=0.01 mol•L-1 | |
| C�� | 0��2min�ڣ�v��I-��=0.01 mol•L-1•min-1 | |
| D�� | ��2minʱ��c��Fe3+��=0.01 mol•L-1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��pH��7ʱ����һ����C1V1��C2V2 | |
| B�� | ��pH��7ʱ�������Һ�п�����c��Na+����c��H+�� | |
| C�� | ��pH=7ʱ����V1=V2����һ����C2=C1 | |
| D�� | �� V1=V2��C1=C2����c��CH3COO-��+c��CH3COOH��=c��Na+�� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com