

| 熔点/℃ | 沸点/℃ | 备注 | |
| 白磷 | 44 | 280.5 | |
| PH3 | -133.8 | -87.8 | 难溶于水、有还原性 |
| SiF4 | -90 | -86 | 易水解 |
分析 (1)由图(a)可知生产含磷肥料,约占磷矿石使用量的比例为:4%+96%×85%×80%=69%;
(2)以磷矿石为原料,用过量的硫酸溶解Ca5F(PO4)3可制得磷酸,根据质量守恒书写化学方程式;根据P元素守恒可得关系式P2O5~2H3PO4,依据此关系式计算;
(3)将SiO2、过量焦炭与磷灰石混合,高温除了反应生成白磷之外,得到的难溶性固体是CaSiO3;根据冷却塔1、2的温度与白磷的熔点比较分析白磷的状态;
(4)二氧化硅和HF反应生成四氟化硅气体,过量的焦炭不完全燃烧生成CO,因此在尾气中主要含有SiF4、CO,还含有少量的PH3、H2S和HF等;将尾气通入纯碱溶液,SiF4、HF、H2S与碳酸钠反应而除去,次氯酸具有强氧化性,可除掉强还原性的PH3;
(5)相比于湿法磷酸,热法磷酸工艺所得产品纯度大.
解答 解:(1)由图(a)可知生产含磷肥料,约占磷矿石使用量的比例为:4%+96%×85%×80%=69%,
故答案为:69%;
(2)以磷矿石为原料,用过量的硫酸溶解Ca5F(PO4)3可制得磷酸,根据质量守恒定律可得反应的化学方程式为Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑;
根据P元素守恒可得关系式P2O5~2H3PO4,142份P2O5可制取196份磷酸,1t折合含有P2O5约30%的磷灰石,含有P2O5的质量为0.3t,所以可制得到85%的商品磷酸的质量为$\frac{196×0.3t}{142×85%}$=0.49t,
故答案为:Ca5F(PO4)3+5H2SO4=3H3PO4+5CaSO4+HF↑;0.49;
(3)将SiO2、过量焦炭与磷灰石混合,高温除了反应生成白磷之外,得到的难溶性固体是CaSiO3;冷却塔1的温度是70℃,280.5℃>t>44℃,所以此时主要的沉积物是液态白磷;冷却塔2的温度是18℃,低于白磷的熔点,故此时的主要沉积物是固体白磷,
故答案为:CaSiO3;液态白磷;固态白磷;
(4)二氧化硅和HF反应生成四氟化硅气体,过量的焦炭不完全燃烧生成CO,因此在尾气中主要含有SiF4、CO,还含有少量的PH3、H2S和HF等;将尾气通入纯碱溶液,SiF4、HF、H2S与碳酸钠反应而除去,次氯酸具有强氧化性,可除掉强还原性的PH3,
故答案为:SiF4、CO;SiF4、H2S、HF;PH3;
(5)相比于湿法磷酸,热法磷酸工艺复杂,能耗高,但是所得产品纯度大,杂质少,因此逐渐被采用,
故答案为:产品纯度高.
点评 本题考查了化工生产流程图,涉及磷矿石的主要用途、反应原理和有关计算,该题是高考中的常见题型,属于中等难度的试题.试题综合性强,侧重对学生分析问题、解答问题能力的培养和解题方法的指导,题目难度中等.


科目:高中化学 来源: 题型:填空题
 我国食盐有80%来自底下井盐和岩盐,用盐井水晒盐是制取食盐的常用方法.
我国食盐有80%来自底下井盐和岩盐,用盐井水晒盐是制取食盐的常用方法.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热46.3 kJ |
| ② | 0.8 | 2.4 | 0.4 | Q(Q>0) |
| A. | 容器①中达到平衡时,Y2的转化率为50% | |
| B. | Q=27.78kJ | |
| C. | 容器①、②中反应的平衡常数相等,K=$\frac{16}{27}$ | |
| D. | 相同温度下;起始时向容器中充入1.0X2mol、3.0molY2和2molXY3;反应达到平衡前v(正)>v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 反应时间/min | n(SO2)/mol | n(O2)/mol |
| 0 | 2 | 1 |
| 5 | 1.2 | |
| 10 | 0.4 | |
| 15 | 0.8 |
| A. | 反应在前5min的平均速率为v (SO2)=0.08mol•L-1•min-1 | |
| B. | 相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40% | |
| C. | 保持温度不变,向平衡后的容器中再充入0.2molSO2和0.2mol SO3时,v (正)>v (逆) | |
| D. | 保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收78.4kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c1:c2=1:3 | |
| B. | 当4v(X)正=v(Y)逆时,该反应还在向逆反应方向建立平衡 | |
| C. | X、Y的转化率不相等 | |
| D. | Y起始浓度c2可能为0.36mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10% | B. | 25% | C. | 50% | D. | 67% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
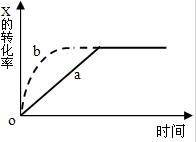 图中曲线a表示放热反应X(g)+Y(g)?Z(g)+N(s)进行过程中X的转化率随时间变化的关系,若只改变一个起始条件,使反应过程按b曲线进行,可采取的措施是( )
图中曲线a表示放热反应X(g)+Y(g)?Z(g)+N(s)进行过程中X的转化率随时间变化的关系,若只改变一个起始条件,使反应过程按b曲线进行,可采取的措施是( )| A. | 升高温度 | B. | 加大X的投入量 | C. | 使用催化剂 | D. | 缩小体积 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
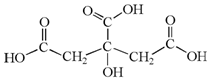 柠檬中含有的柠檬酸(其结构简式如下)对鲜切苹果具有较好的保鲜效果,可以在一段时间内防止鲜切苹果表面变色.下列说法不正确的是( )
柠檬中含有的柠檬酸(其结构简式如下)对鲜切苹果具有较好的保鲜效果,可以在一段时间内防止鲜切苹果表面变色.下列说法不正确的是( )| A. | 柠檬酸的分子式是C6H8O7 | B. | 柠檬酸是易溶于水的有机物 | ||
| C. | 柠檬酸分子中含有羧基和羟基 | D. | 柠檬酸只能发生取代反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com