
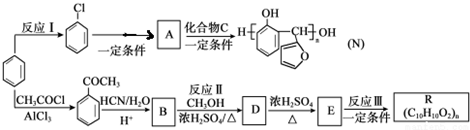
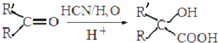
 的反应类型是取代反应,D生成E的过程中,浓硫酸的作用是催化剂和脱水剂•
的反应类型是取代反应,D生成E的过程中,浓硫酸的作用是催化剂和脱水剂•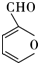
 .
.
分析 苯与氯气发生取代反应生成氯苯,氯苯反应得到A,A与C反应得到N,结合N的结构及信息反应Ⅱ可知,A的结构简式为 ,C的结构简式为:
,C的结构简式为: ;反应①应是在氢氧化钠水溶液、加热条件下水解后酸化;苯与CH3COCl发生取代反应生成
;反应①应是在氢氧化钠水溶液、加热条件下水解后酸化;苯与CH3COCl发生取代反应生成 ,由反应信息Ⅰ可知B为
,由反应信息Ⅰ可知B为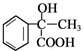 ,B与甲醇发生酯化反应生成D为
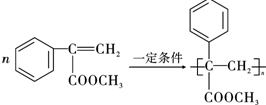
,B与甲醇发生酯化反应生成D为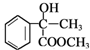 ,D发生消去反应生成E为
,D发生消去反应生成E为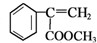 ,E发生加聚反应生成R为
,E发生加聚反应生成R为 ,据此进行解答.
,据此进行解答.
解答 解:苯与氯气发生取代反应生成氯苯,氯苯反应得到A,A与C反应得到N,结合N的结构及信息反应Ⅱ可知,A的结构简式为 ,C的结构简式为:
,C的结构简式为: ;反应①应是在氢氧化钠水溶液、加热条件下水解后酸化;苯与CH3COCl发生取代反应生成
;反应①应是在氢氧化钠水溶液、加热条件下水解后酸化;苯与CH3COCl发生取代反应生成 ,由反应信息Ⅰ可知B为
,由反应信息Ⅰ可知B为 ,B与甲醇发生酯化反应生成D为
,B与甲醇发生酯化反应生成D为 ,D发生消去反应生成E为
,D发生消去反应生成E为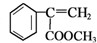 ,E发生加聚反应生成R为
,E发生加聚反应生成R为 ,
,
(1)苯和氯气需要在氯化铁作催化剂条件下发生取代反应,故答案为:Cl2/Fe粉(或Cl2/FeCl3);
(2)根据反应前后结构简式知,该反应是取代反应,D生成E的过程中,浓硫酸的作用是催化剂和脱水剂,
故答案为:取代反应;催化剂和脱水剂;
(3)B中含氧官能团为羟基和羧基,C结构简式为 ,故答案为:羟基、羧基;
,故答案为:羟基、羧基; ;
;
(4)该反应方程式为 ,故答案为:
,故答案为: ;
;
(5)a、 在常温下微溶于水,高于65℃时,能和水混溶,故错误;
在常温下微溶于水,高于65℃时,能和水混溶,故错误;
b. 具有酸性,可与NaOH溶液发生中和反应,故正确;
具有酸性,可与NaOH溶液发生中和反应,故正确;
c、C中含有碳碳不饱和键,所以化合物C可使高锰酸钾酸性溶液褪色,故正确;
d.E为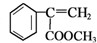 ,碳碳双键中其中一个碳原子连接2个H原子,没有顺反异构体,故错误;
,碳碳双键中其中一个碳原子连接2个H原子,没有顺反异构体,故错误;
故选bc;
(6)该反应方程式为 ,故答案为:
,故答案为:
;
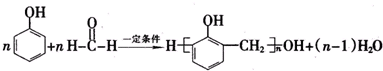
(7)B为 ,B的同分异构体符合下列条件:a.能与饱和溴水反应生成白色沉淀,说明含有酚羟基; b.属于酯类,说明含有酯基; c.苯环上只有两个对位取代基,
,B的同分异构体符合下列条件:a.能与饱和溴水反应生成白色沉淀,说明含有酚羟基; b.属于酯类,说明含有酯基; c.苯环上只有两个对位取代基,
另外的取代基为:-OOCCH2CH3、或-CH2OOCCH3、或-COOCH2CH3、或-CH2CH2OOCH、或-CH(CH3)OOCH、或-CH2COOCH3,有6种,故答案为:6.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析推断及知识综合应用能力,明确官能团及其性质关系是解本题关键,根据某些物质结构简式、分子式、反应条件进行推断,难点是同分异构体种类判断,题目难度中等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由于相对分子质量:HCl>HF,故沸点:HCl>HF | |
| B. | 由于氮元素的最低化合价只有-3价,故NH5这种物质不可能存在 | |
| C. | 硅处于金属与非金属的过渡位置,硅可用作半导体材料 | |
| D. | Cl-、S2-、Ca2+、K+半径逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
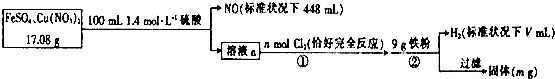
| A. | V=2240 | |
| B. | n=0.02 | |
| C. | 原混合物中FeS04的质量分数约为89% | |
| D. | m=0.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| B. | 分液操作时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出 | |
| C. | 萃取操作时,可以选用CCl4或酒精作为萃取剂从溴水中萃取溴 | |
| D. | 蒸馏操作时,应向蒸馏液体中加入几块沸石,以防止暴沸 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 向NaHCO3溶液中加入足量的Ba(OH)2溶液2HCO3-+Ba2++2OH-═BaCO3↓+CO32-+2H2O | |
| B. | 向石灰石中滴加稀硝酸CaCO3+2H+═Ca2++CO2↑+H2O | |
| C. | 用惰性电极电解KOH溶液时阴极电极反应2H2O-4e-═O2+4H+ | |
| D. | NaOH溶液中通入少量硫化氢气体:2OH-+H2S═S2-+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 开始沉淀的pH | 沉淀完全的pH | |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 5.9 | 8.9 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com