
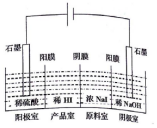
 氢碘酸(HI)可用“四室式电渗析法”制备,其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过).下列叙述错误的是( )
氢碘酸(HI)可用“四室式电渗析法”制备,其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过).下列叙述错误的是( )| A. | 通电后,阴极室溶液pH增大 | |
| B. | 阳极电极反应式是2H2O-4e-═4H++O2↑ | |
| C. | 得到l mol产品HI,阳极室溶液质量减少8g | |
| D. | 通电过程中,NaI的浓度逐渐减小 |
分析 制备氢碘酸,则阳极上是硫酸溶液中的氢氧根失电子发生氧化反应,生成大量H+,则H+离子要移向产品室,在阴极上是氢氧化钠溶液中的H+放电,导致溶液带负电性,吸引原料室中NaI的Na+移向阴极,则I-移向产品室,据此分析解答;
解答 解:A、通电后,阴极室上是氢氧化钠溶液中的H+放电,则溶液pH增大,故A正确;
B、阳极上是硫酸溶液中的氢氧根失电子发生氧化反应,电极反应式是2H2O-4e-═4H++O2↑,故B正确;
C、得到l mol产品HI,则转移l mol电子,又阳极电极反应式是2H2O-4e-═4H++O2↑,所以消耗0.5mol水即9g,故C错误;
D、通电过程中,在阴极上是氢氧化钠溶液中的H+放电,导致溶液带负电性,吸引原料室中NaI的Na+移向阴极,则I-移向产品室,所以NaI的浓度逐渐减小,故D正确.
故选C.
点评 本题考查了电解池原理以及电极反应式的书写,难度适中,应注意的是任何电解质溶液必须保持电中性.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| W | |||
| Y | Z |
| A. | X能分别与Y、W形成化合物,且其所含化学键类型完全相同 | |
| B. | W有多种同素异形体,且均具有高熔点、高沸点的性质 | |
| C. | X的离子半径一定小于Y同族的短周期元素的离子半径 | |
| D. | Y、Z与X的常见稳定液态氧化物反应的剧烈程度Y大于Z |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
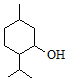
| A. | 薄荷醇分子式为C10H20O,它是环己醇的同系物 | |
| B. | 薄荷醇的分子中至少有12个原子处于同一平面上 | |
| C. | 薄荷醇在Cu或Ag做催化剂、加热条件下能被O2氧化为醛 | |
| D. | 在一定条件下,薄荷醇能发生取代反应、消去反应和聚合反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅太阳能电池利用的是原电池原理 | B. | 草木灰与硝酸铵混成复合肥施用 | ||
| C. | 硅胶可用作瓶装药品的干燥剂 | D. | 用于发酵的小苏打属于碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上,采用电解MgCl2溶液的方法制取金属镁 | |
| B. | 利用太阳能等淸洁能源代替化石燃料,有利于节约资源、保护环境 | |
| C. | 硬币材质一般都是合金,所有的不锈钢中都含有非金属元素 | |
| D. | 使用含钙、镁离子浓度较大的地下水洗衣服,肥皂去污能力会减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com