
分析 (1)达平衡时,在相同温度下测得容器内混合气体的压强是反应前的0.8倍,说明平衡时气体的物质的量时反应前的0.8倍.设反应中消耗A的物质的量是xmol,则消耗B为0.5xmol,生成Cxmol,则平衡是气体的物质的量是2-x+2-0.5x+x=4-0.5x,根据题意有(2+2)×0.8=4-0.5x,解得x=1.6,A的转化率=$\frac{参加反应的A的物质的量}{A的初始物质的量}×100%$;
(2)金属与足量稀硝酸反应,为产生气体,说明硝酸被还原的产物与硝酸反应生成盐;与氢氧化钠溶液反应,加热产生气体,说明此气体为氨气,物质的量是$\frac{0.224L}{22.4L/mol}$=0.01mol,则根据氨气和转移电子之间的关系式计算;
(3)2.56gCu的物质的量是2.56g/64g/mol=0.04mol,在混合酸中氢离子的物质的量是0.1L×(0.1+0.4×2)mol/L=0.09mol.硝酸根离子的物质的量是0.1L×0.1mol/L=0.01mol.Cu与混合酸反应的离子方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4 H2O,根据离子方程式可知,Cu、氢离子均过量,所以按硝酸根离子的物质的量进行计算.所以消耗Cu的物质的量是0.01mol×$\frac{3}{2}$=0.015mol,再根据c=$\frac{n}{V}$计算浓度;
(4)1L2mol/L的AlCl3溶液中,氯化铝的物质的量是2mol,39g沉淀为氢氧化铝,物质的量是0.5mol,可知铝元素未完全沉淀.若氢氧化钠不足,根据元素守恒,则消耗氢氧化钠的物质的量为0.5mol×3=1.5mol,溶液体积=$\frac{n}{c}$;
若氢氧化钠过量,则铝离子一部分与氢氧根离子生成氢氧化铝沉淀,一部分与过量氢氧根离子生成偏铝酸根离子,根据铝元素守恒,则偏铝酸根离子的物质的量是2mol-0.5mol=1.5mol,根据4OH-~AlO2-,所以此时消耗的氢氧根离子的物质的量是偏铝酸根离子的4倍,为1.5mol×4=6.0mol,所以共消耗氢氧化钠的物质的量是1.5+6=7.5mol,溶液体积=$\frac{n}{c}$;
(5)Na、Mg、Al的物质的量相同,均是0.2mol,与HCl反应时,若盐酸过量,则产生的氢气量肯定不相同,其中Na产生的氢气最少.所以若产生的氢气的量相同,则HCl不足,此时生成的氢气的量按照HCl的量进行计算,所以以钠为标准,判断需要盐酸的体积,0.2molNa完全反应生成0.1mol氢气,消耗HCl的物质的量是0.2mol,溶液体积=$\frac{n}{c}$;
(6)溶液中加入VmL n mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,此时溶液为硝酸钠溶液,根据钠元素守恒,可知未被还原的硝酸的物质的量为$\frac{nV}{1000}$ mol;被还原的硝酸的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,所以原溶液中硝酸的物质的量是(0.5+$\frac{nV}{1000}$ )mol,则原硝酸溶液的物质的量浓度=$\frac{n}{V}$;
(7)根据题意可知,2mol氢气完全燃烧生成水蒸气时放出的热量是4akJ,热化学方程式是2H2(g)+O2(g)=2H2O(g)△H=-4akJ/mol.根据反应热和键能的关系反应热=反应物的总键能-生成物的总键能.
解答 解:(1)达平衡时,在相同温度下测得容器内混合气体的压强是反应前的0.8倍,说明平衡时气体的物质的量时反应前的0.8倍.设反应中消耗A的物质的量是xmol,则消耗B为0.5xmol,生成Cxmol,则平衡是气体的物质的量是2-x+2-0.5x+x=4-0.5x,根据题意有(2+2)×0.8=4-0.5x,解得x=1.6,所以A的转化率是$\frac{1.6mol}{2mol}$×100%=80%,
故答案为:80%;
(2)金属与足量稀硝酸反应,为产生气体,说明硝酸被还原的产物与硝酸反应生成盐;与氢氧化钠溶液反应,加热产生气体,说明此气体为氨气,物质的量是$\frac{0.224L}{22.4L/mol}$=0.01mol,则此过程中转移电子的物质的量是0.01mol×[5-(-3)]=0.08mol,故答案为:0.08;
(3)2.56gCu的物质的量是2.56g/64g/mol=0.04mol,在混合酸中氢离子的物质的量是0.1L×(0.1+0.4×2)mol/L=0.09mol.硝酸根离子的物质的量是0.1L×0.1mol/L=0.01mol.Cu与混合酸反应的离子方程式为3Cu+2NO3-+8H+=3Cu2++2NO↑+4 H2O,根据离子方程式可知,Cu、氢离子均过量,所以按硝酸根离子的物质的量进行计算.所以消耗Cu的物质的量是0.01mol×$\frac{3}{2}$=0.015mol,则所得溶液中 Cu2+的物质的量浓度是$\frac{0.015mol}{0.1L}$=0.15mol/L,
故答案为:0.15;
(4)1L2mol/L的AlCl3溶液中,氯化铝的物质的量是2mol,39g沉淀为氢氧化铝,物质的量是0.5mol,可知铝元素未完全沉淀.若氢氧化钠不足,根据元素守恒,则消耗氢氧化钠的物质的量为0.5mol×3=1.5mol,消耗1mol/L氢氧化钠溶液的体积是$\frac{1.5mol}{1mol/L}$=1.5L;若氢氧化钠过量,则铝离子一部分与氢氧根离子生成氢氧化铝沉淀,一部分与过量氢氧根离子生成偏铝酸根离子,根据铝元素守恒,则偏铝酸根离子的物质的量是2mol-0.5mol=1.5mol,根据4OH-~AlO2-,所以此时消耗的氢氧根离子的物质的量是偏铝酸根离子的4倍,为1.5mol×4=6.0mol,所以共消耗氢氧化钠的物质的量是1.5+6=7.5mol,则氢氧化钠溶液的体积是$\frac{7.5mol}{1mol/L}$=7.5L,
故答案为:1.5L或7.5L;
(5)Na、Mg、Al的物质的量相同,均是0.2mol,与HCl反应时,若盐酸过量,则产生的氢气量肯定不相同,其中Na产生的氢气最少,所以若产生的氢气的量相同,则HCl不足,此时生成的氢气的量按照HCl的量进行计算.所以以钠为标准,判断需要盐酸的体积.0.2molNa完全反应生成0.1mol氢气,消耗HCl的物质的量是0.2mol,需要1mol/L盐酸的体积是$\frac{0.2mol}{1mol/L}$=0.2L=200mL,
故答案为:200;
(6)溶液中加入VmL n mol/L的NaOH溶液,恰好使溶液中的Cu2+全部转化成沉淀,此时溶液为硝酸钠溶液,根据钠元素守恒,可知未被还原的硝酸的物质的量为$\frac{nV}{1000}$ mol;被还原的硝酸的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,所以原溶液中硝酸的物质的量是(0.5+$\frac{nV}{1000}$ )mol,则原硝酸溶液的物质的量浓度为$\frac{(0.5+\frac{nV}{1000})mol}{0.1L}$=(5+$\frac{nV}{100}$)mol/L,
故答案为:(5+$\frac{nV}{100}$);
(7)根据题意可知,2mol氢气完全燃烧生成水蒸气时放出的热量是4akJ,热化学方程式是2H2(g)+O2(g)=2H2O(g)△H=-4akJ/mol.根据反应热和键能的关系反应热=反应物的总键能-生成物的总键能,设1 mol H-H键断裂时吸收热量为x,所以-4a=2x+b-2×2c,解得x=$\frac{4c-b-4a}{2}$,
故答案为:$\frac{4c-b-4a}{2}$.
点评 本题考查化学方程式的计算、热化学反应方程式的计算等知识点,为高频考点,侧重考查学生分析计算能力,明确各个物理量之间的关系式水解本题关键,注意(4)题中可能NaOH不足量也可能过量,为易错题.


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:选择题
| A. | 蛋白质、淀粉、硝化纤维、油脂都属于高分子化合物 | |
| B. | 聚丙烯能使溴水褪色 | |
| C. | 氯丁橡胶在空气中燃烧只生成CO2和H2O | |
| D. | 利用木材作原料制得的纤维是人造纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ①②③⑥ | C. | ③⑥ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
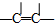 | ─C≡C─ | ─CH3 | ─CH2CH3 或─C2H5 | ─OH | ─CHO | ─COOH | -COO-R |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 火力发电厂的煤经粉碎、脱硫处理 | B. | 电镀废液经中和后直接排入到农田 | ||
| C. | 聚乳酸塑料代替传统塑料作购物袋 | D. | 回收并合理处理聚氯乙烯塑料废物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阿伏加德罗常数是12 g碳中所含的碳原子数 | |
| B. | 24 g镁的原子最外层电子数为NA | |
| C. | 阿伏加德罗常数约是6.02×1023 | |
| D. | 阿伏加德罗常数的符号为NA,近似为6.02×1023 mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
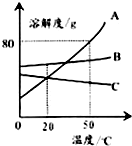
| A. | 50℃时A物质的溶解度最大 | |
| B. | 升温可使C物质的不饱和溶液变成饱和溶液 | |
| C. | 50℃时把90gA物质放入100g水中能得到190g溶液 | |
| D. | 将50℃三种物质的饱和溶液分别降温到20℃时,B溶液溶质质量分数最大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com