
【题目】在冶金工业上,均不能用常见化学还原剂制得的金属组是( )
A.Na、Ba、Mg、Al
B.Na、K,Zn、Fe
C.Zn、Fe、Cu、Ag
D.Mg、Al、Zn、Fe
科目:高中化学 来源: 题型:
【题目】取等物质的量浓度的NaOH溶液两份A和B,每份100mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1mol/L的盐酸,标准状况下产生的CO2气体体积与所加的盐酸体积之间的关系如图所示。下列说法正确的是
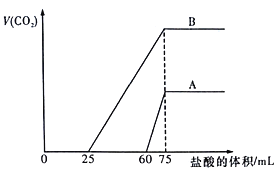
A. B曲线中消耗盐酸0<V(HCl)<25mL时发生的离子反应为: OH-+H+=H2O,H++CO32-=HCO3-
B. 原NaOH溶液的物质的量浓度为0.75mol/L
C. B曲线最终产生的CO2体积(标准状况下)为112mL
D. 加盐酸之前A溶液中的溶质是碳酸钠和碳酸氢钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将氯气通入到氢氧化钠溶液中,反应得到NaCl,NaClO,NaClO3的混合溶液,经测定溶液中c(ClO)∶c(ClO)=1∶3.则氯气与氢氧化钠溶液反应时被还原的氯原子与被氧化的氯原于的数目之比为
A. 21:5 B. 4:1 C. 3:1 D. 11:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】荧光素(X)常用于钞票等防伪印刷,下列关于它的说法正确的是( ) 
A.1 mol X与足量的NaOH溶液在常温常压下反应,最多消耗3molNaOH
B.X能与糠醛( ![]() )发生缩聚反应
)发生缩聚反应
C.1molX与足量的浓溴水反应,最多消耗4 mol Br2
D.1molX最多能与9mol氢气反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质:①氢氧化钠溶液、②铜片、③碳酸钙、④蔗糖、⑤熔融的NaCl、⑥SO2气体、⑦碳酸氢钠、⑧盐酸
(1)能导电且属于电解质的是___________。(填编号)
(2)写出碳酸钙的电离方程式____________________________________。
(3)写出碳酸氢钠与氢氧化钠反应的离子方程式____________________________________。
(4)向100mL1.5mol/L的氢氧化钠溶液中缓慢通入一定量的CO2,反应后,向所得溶液中逐滴缓慢滴加一定浓度的盐酸,所得气体的体积与所加盐酸的体积(不考虑气体溶解于水)关系如图所示。
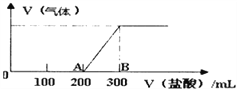
则
①氢氧化钠溶液与一定量的CO2充分反应后的溶液中溶质为_________(写化学式)。
②盐酸的浓度为________________________。
③B点时,产生的气体在标准状况下的体积为_________________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将10mL质量分数为50%(密度1.4g/mL)的硫酸稀释成100mL,下列说法正确的是( )
A.纯硫酸的摩尔质量为98
B.上述100mL稀硫酸中含溶质14g
C.上述稀释过程所需要的蒸馏水为90mL
D.质量分数为50%的硫酸物质的量浓度为7.14mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室制备四氯化硅液体的装置。已知:四氯化硅熔点为-70℃,沸点57.6℃,遇水极易反应。

请回答下列问题。
(1)写出装置A中发生反应的离子方程式_______________________________。
(2)8.7 g MnO2 和足量的浓盐酸反应,其中被氧化的HCl的物质的量为____________mol。
(3)装置B中盛放的试剂是__________________;
(4)g管的作用是_________________。
(5)装置E中冰水的作用是_________________。
(6)干燥管F中碱石灰的作用是______________和_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组为测定某含镁3%~5%的铝镁合金(不含其他元素)中镁的质量分数,设计了下列实验方案进行探究,请根据他们的设计回答有关问题。
实验方案:铝镁合金![]() 测定剩余固体质量。
测定剩余固体质量。
问题讨论:
(1)实验中发生反应的化学方程式是______________________________。
(2)若实验中称取5.4 g 铝镁合金粉末样品,投入V mL 2.0 mol/LNaOH 溶液中,充分反应。则NaOH 溶液的体积V≥_________mL。
(3)实验中,当铝镁合金充分反应后,在称量剩余固体质量前,还需进行的实验操作按顺序依次为_______________、洗涤、_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知下列两个反应:①Fe+H2SO4(稀)=FeSO4+H2![]() ;②Cu+2H2SO4(浓)=CuSO4+SO2
;②Cu+2H2SO4(浓)=CuSO4+SO2![]() +2H2O。试回答下列问题:
+2H2O。试回答下列问题:
(1)反应①中_______元素被还原,反应②中_______元素被还原.(填元素符号)
(2)当反应①生成2gH2时,消耗H2SO4的质量是_______克。
(3)反应②中生成32gSO2气体时,转移_______mol电子。
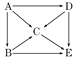
(4)图中表示A~E五种物质的转化关系.若将它们灼烧,火焰都呈黄色;A能跟水起剧烈反应,D常用作潜水艇里的氧气来源.试推断A~E各物质(写化学式):
A_________;B_________;C_________;D_________;E__________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com