
| A. | 煅烧黄铁矿(FeS2)制SO2 | B. | 电解熔融氧化铝制金属铝 | ||
| C. | 钠与水反应制烧碱 | D. | 氯气与石灰乳反应制漂白粉 |
分析 A.黄铁矿煅烧生成二氧化硫;
B.Al为活泼金属,通常用电解熔融的氧化铝的方法冶炼;
C.工业上用电解饱和食盐水法制备烧碱;
D.氯气和石灰乳反应生成次氯酸钙、氯化钙.
解答 解:A.黄铁矿煅烧生成二氧化硫,所以适用于工业生产,故A错误;
B.Al为活泼金属,通常用电解熔融的氧化铝的方法冶炼,所以适用于工业生产,故B错误;
C.工业上用电解饱和食盐水法制备烧碱,钠与水反应制烧碱,成本太高,故C正确;
D.漂白粉的有效成分是次氯酸钙,氯气和石灰乳反应生成次氯酸钙、氯化钙,石灰乳较廉价,所以适用于工业生产,故D错误.
故选C.
点评 本题以化学反应为载体考查了理论与实际,工业生产要考虑成本问题,根据物质间的反应结合成本分析解答,题目难度不大.


 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
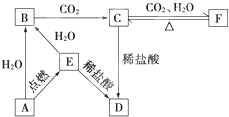
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤燃烧是化学能转化为光能的过程 | |
| B. | 1 mol 甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 | |
| C. | HCl 和 NaOH 反应的中和热△H=-57.3 kJ•mol-1,则 H2SO4 和 Ca(OH)2 反应中和热△H=2×(-57.3)kJ•mol-1 | |
| D. | 反应 H2(g)+F2(g)═2HF(g);△H=-270 kJ•mol-1说明在相同条件下,1 mol 氢气与 1 mol 氟气的能量总和大于2 mol 氟化氢气体的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.75 mol | B. | 1.5 mol | C. | 1.0 mol | D. | 0.67 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 32gO2和O3混合气体中所含的原子数目为2NA | |
| B. | 20℃时,铝的密度为2.7g•cm-3,则1个Al原子的体积为$\frac{22.4}{{N}_{A}}$cm3 | |
| C. | 标况下,NA个N2分子的体积约为22.4L,则1个N2分子的体积为$\frac{10}{{N}_{A}}$L | |
| D. | 0.5NA个氯气分子的物质的量是0.5mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将(CH3)3CCH2Cl与氢氧化钾的乙醇溶液加热一段时间后冷却,再滴加硝酸酸化的硝酸银溶液,可观察到有白色沉淀产生 | |
| B. | 新制氢氧化铜悬浊液可检验失去标签的乙醛、乙酸、乙酸乙酯(必要时可加热) | |
| C. | 在鸡蛋清溶液中分别加入饱和Na2SO4、CuSO4溶液,都会因盐析产生沉淀 | |
| D. | 向淀粉溶液中加稀硫酸,加热几分钟,冷却后加入新制氢氧化铜悬浊液,若加热后未见砖红色沉淀生成,说明淀粉未开始水解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
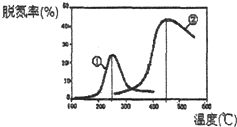 进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”.引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气.
进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”.引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气.时间/min 温度/℃ | 0 | 10 | 20 | 40 | 50 |
| T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
| T2 | 1.2 | 0.8 | 0.56 | … | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com