���ڹ�����ռ����Ҫ��λ��
��1���ϳɰ���ҵ�У��ϳ�����ÿ����2mol NH
3���ų�92.2kJ������
�ٹ�ҵ�ϳɰ����Ȼ�ѧ����ʽ��
��
������ʼʱ�������ڷ���2mol N
2��6mol H
2����ƽ���ų�������ΪQ����Q�����������������=����
184.4kJ��
����֪��

1mol N-H���������յ�����Լ����
kJ��
��2����ҵ�������ص�ԭ������NH
3��CO
2Ϊԭ�Ϻϳ�����[CO��NH
2��
2]����Ӧ�Ļ�ѧ����ʽΪ��2NH
3��g��+CO
2��g��?CO��NH
2��
2��l��+H
2O��l�����÷�Ӧ��ƽ�ⳣ�����¶ȹ�ϵ���£�
| T/�� |
165 |
175 |
185 |
195 |
| K |
111.9 |
74.1 |
50.6 |
34.8 |
���ʱ��H�����������������=����
0
����һ���¶Ⱥ�ѹǿ�£���ԭ�����е�NH
3��CO
2�����ʵ���֮�ȣ���̼�ȣ�
=x����ͼ�ǰ�̼�ȣ�x����CO
2ƽ��ת���ʣ������Ĺ�ϵ��������x����������ԭ����
��
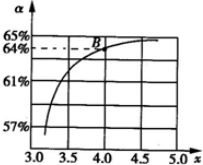
����ͼ�е�B�㴦��NH
3��ƽ��ת����Ϊ
��
��3���������Ʊ������������һ����Ҫ���ʣ������Ļ�������;�㷺��
���������õ����Ʊ������������һ��;����

�ٹ��̢�Ļ�ѧ����ʽ��
��
������ʱ���Ͻ�NH
3��±�أ���Cl
2����װ���䣮�����߽Ӵ�ʱ���ҷ�Ӧ�������̣�����0.4mol NH
3�μӷ�Ӧʱ��0.3mol ����ת�ƣ�д����Ӧ�Ļ�ѧ����ʽ
��
�۰���һ��DZ�ڵ������Դ������������ȼ�ϵ�ص�ȼ�ϣ�
��֪��4NH
3��g��+3O
2��g���T2N
2��g��+6H
2O��g����H=-1316kJ/mol�����ȼ�ϵ�صĸ�����Ӧʽ��
��






 ��������ܸ�ϰϵ�д�
��������ܸ�ϰϵ�д�

