
【题目】常温下,向100mL0.lmol/LNH4Cl溶液中,逐滴滴加0.1mol/LNaOH溶液。NH4+和NH3H2O的变化趋势如图所示(不考虑生成NH3,已知NH3H2O的kb=1.8![]() 10-5),下列说法正确的是( )
10-5),下列说法正确的是( )
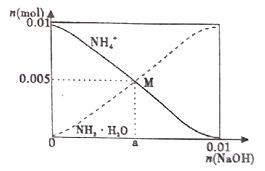
A.a=0.005
B.在M点时,n(H+)—n(OH—)=(0.005—a)mol
C.随着NaOH溶液的滴加,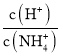 不断增大
不断增大
D.当n((NaOH)) =0.01 mol 时,c ((NH3H2O)![]() c (Na+)
c (Na+)![]() c (OH-)
c (OH-)
【答案】B
【解析】
A.由图可知,M点含等量的氯化铵和NH3H2O,由NH3H2O![]() NH4++ OH-,可知此时溶液中kb=1.8
NH4++ OH-,可知此时溶液中kb=1.8![]() 10-5=
10-5=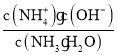 ,则c(OH-)= 1.8
,则c(OH-)= 1.8![]() 10-5mol/L,溶液显碱性,即n(OH-)- n(H+)>0,由溶液中存在的电荷守恒式为n(OH-)+n(Cl-)=n(H+)+n(Na+)+n(NH4+),n(Na+)= n(OH-)+n(Cl-)- n(NH4+)- n(H+)=0.005+ n(OH-)- n(H+)>0.005,即a>0.005,故A错误;
10-5mol/L,溶液显碱性,即n(OH-)- n(H+)>0,由溶液中存在的电荷守恒式为n(OH-)+n(Cl-)=n(H+)+n(Na+)+n(NH4+),n(Na+)= n(OH-)+n(Cl-)- n(NH4+)- n(H+)=0.005+ n(OH-)- n(H+)>0.005,即a>0.005,故A错误;
B.M点n(OH-)+n(Cl-)=n(H+)+n(Na+)+n(NH4+),n(H+)-n(OH-)=n(Cl-)-0.005-n(Na+)=(0.005-a)mol,故B正确;
C.随着NaOH溶液的滴加,c(NH3H2O)减小,且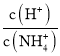 =
=![]() ,可知比值不断减小,故C错误;
,可知比值不断减小,故C错误;
D.当n(NaOH)=0.01mol时,恰好反应生成等量的氯化钠和一水合氨,一水合氨电离,则c( Na+)>c(NH3H2O)>c(OH-),故D错误;
故答案为B。


科目:高中化学 来源: 题型:
【题目】苯甲酸是一种重要的化工产品,某学习小组设计方案制备苯甲酸。反应原理如下:C6H5-CH3+2KMnO4![]() C6H5-COOK+KOH+2MnO2↓+H2O,C6H5-COOK+HCl→C6H5-COOH+KCl,已知甲苯的熔点为-95℃,沸点为110.6℃,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4℃,在25℃和95℃下溶解度分别为0.3g和6.9g。
C6H5-COOK+KOH+2MnO2↓+H2O,C6H5-COOK+HCl→C6H5-COOH+KCl,已知甲苯的熔点为-95℃,沸点为110.6℃,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4℃,在25℃和95℃下溶解度分别为0.3g和6.9g。
(制备产品)30.0mL甲苯和25.0mL1mol/L高锰酸钾溶液在80℃下反应30min,装置如图所示:

(1)仪器a的名称是___,图中支管的作用是______;
(2)相对于用酒精灯直接加热,用沸水浴加热的优点是_____,在本实验中,三颈烧瓶最合适的容积是___(填字母);
A.50mL B.100mL C.200mL D.250mL
(分离产品)他们设计如下流程分离粗产品苯甲酸和回收甲苯:

(3)操作Ⅰ的名称是____;含杂质的产物经操作Ⅱ进一步提纯得无色液体A,则操作Ⅱ的名称是_____;
(4)操作Ⅲ的名称是_____,固体B中可能会有________杂质离子,检验该离子的方法是_________;提纯B所用的方法是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制Cl2反应为4HCl(浓)+MnO2![]() MnCl2+Cl2↑+2H2O,下列说法不正确的是
MnCl2+Cl2↑+2H2O,下列说法不正确的是
A. 还原剂是HCl,氧化剂是MnO2
B. 每生成1mol Cl2,转移电子的物质的量为2mol
C. 每消耗1mol MnO2,起还原剂作用的HCl消耗4mol
D. 转移电子的物质的量为1mol时,生成标准状况下Cl2的体积为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学反应的离子方程式正确的是( )
A. 用小苏打治疗胃酸过多:HCO3-+H+===CO2↑+H2O
B. 往碳酸镁中滴加稀盐酸:CO32-+2H+===CO2↑+H2O
C. 往澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2===CaCO3↓+H2O
D. 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-===BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E的原子序数依次增大,其单质常温下有三种气态两种固态,A和B形成的气态化合物的水溶液可使红色石蕊试纸变蓝,A和C同主族,D原子最外层电子数与电子层数相等,E的原子半径在同周期最小,下列说法不正确的是:
A. 原子半径大小:r(D) > r(E)
B. C和氧元素形成的化合物可能含有非极性键
C. E形成的单质具有漂白性
D. C、D的最高价氧化物对应的水化物之间能发生反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,体积为VL两容器分别充满了CO气体和CO2气体,下列有关说法不正确的是( )
A.两容器含有气体分子数目相同
B.两容器气体密度之比为:7:11
C.两容器中所含氧原子个数之比为:1:2
D.两容器所含气体的物质的量均为:![]() mol
mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】准确移取20.00mL某待测 NaOH溶液于锥形瓶中,用0.1000mol·L-1盐酸滴定。用酚酞作指示剂,下列说法不正确的是:
A. 常温下,0.1000mol·L-1盐酸pH=1
B. 酸式滴定管用蒸馏水洗涤后,再用盐酸润洗
C. 随着盐酸的滴入,锥形瓶中溶液pH逐渐变小
D. 当滴入最后一滴盐酸时,溶液由无色变为浅红色,且30s内不褪色,即为滴定终点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有硫酸镁溶液500mL,它的密度是1.20g·cm3,其中镁离子的质量分数是4.8%,则有关该溶液的说法不正确的是
A. 溶质的质量分数是24% B. 溶液的物质的量浓度是2.4mol·L1
C. 溶质和溶剂的物质的量之比约为1∶21.1 D. 硫酸根离子的质量是230.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2SO2(g)+O2(g)![]() 2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应速率与反应时间的关系如图所示.下列说法正确的是( )
2SO3(g)△H<0,在一定条件下达到平衡状态,时间为t1时改变条件.化学反应速率与反应时间的关系如图所示.下列说法正确的是( )
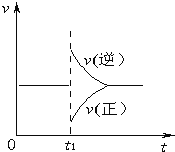
A. 维持温度、容积不变,t1时充入SO3(g)
B. 维持压强不变,t1时升高反应体系温度
C. 维持温度、容积不变,t1时充入一定量Ar
D. 维持温度、压强不变,t1时充入SO3(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com