
| A. | 活性炭、SO2、Na2O2都能使品红溶液褪色,但原理不同 | |
| B. | 非金属氧化物不一定是酸性氧化物,金属氧化物多数是碱性氧化物 | |
| C. | 同温同压下,两份相同质量的铁粉,分别与足量的稀硫酸和稀硝酸反应,产生气体的体积不同 | |
| D. | 将SO2气体通入BaCl2溶液中至饱和未见沉淀生成,继续通入NO2则有沉淀生成 |
分析 A.活性炭具有吸附性,SO2与有色物质化合生成无色物质,Na2O2具有强氧化性;
B.非金属氧化物分为酸性氧化物和不成盐氧化物,金属氧化物大部分属于碱性氧化物;
C.足量的稀硫酸和稀硝酸反应,与Fe发生的反应不同,Fe~H2SO4~H2↑、Fe~4HNO3~NO↑;
D.SO2气体通入BaCl2溶液中,不反应,继续通入NO2,发生氧化还原反应生成硫酸根离子,再与钡离子结合.
解答 解:A.活性炭为吸附性,SO2与有色物质化合生成无色物质,Na2O2具有强氧化性,则能使品红溶液褪色,但原理不同,故A正确;
B.非金属氧化物分为酸性氧化物和不成盐氧化物,如CO为非金属氧化物,但不是酸性氧化物,金属氧化物大部分属于碱性氧化物,如氧化钠、氧化镁等,故B正确;
C.足量的稀硫酸和稀硝酸反应,与Fe发生的反应不同,由Fe~H2SO4~H2↑、Fe~4HNO3~NO↑可知,等量的Fe反应产生气体的体积相等,故C错误;
D.SO2气体通入BaCl2溶液中,不反应,继续通入NO2,生成硝酸,SO2与硝酸发生氧化还原反应生成硫酸根离子,再与钡离子结合生成硫酸钡沉淀,故D正确;
故选C.
点评 本题考查物质的性质,为高频考点,综合考查元素化合物知识,把握漂白原理、发生的氧化还原反应及除杂的方法为解答的关键,选项B中发生的反应为解答的易错点,题目难度不大.


 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:选择题
| A. | 利用丁达尔效应可区分蛋白质溶液与葡萄糖溶液 | |
| B. | 将饱和FeCl3溶液滴入沸水中,将继续煮沸至溶液呈红褐色即生成氢氧化铁胶体 | |
| C. | 用过滤法可以除去Fe(OH)3胶体中的FeCl3 | |
| D. | 用豆浆中加入硫酸钙制豆腐,是利用了胶体的聚沉性质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该溶液中最多存在4种离子 | |
| B. | 该溶液可由KCl、(NH4)2SO4和FeCl3配制而成 | |
| C. | 该溶液中一定存在Cl-、且c(Cl-)≥0.4mol•L-1 | |
| D. | 该溶液中不能确定是否存在CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 试剂 | 试纸/试液 | 现象 | 结论 |
| A | 浓氨水、生石灰 | 红色石蕊试纸 | 变蓝 | NH3为碱性气体 |
| B | 浓盐酸、浓硫酸 | 紫色石蕊试纸 | 变红 | HCl为酸性气体 |
| C | 浓盐酸、二氧化锰 | 淀粉碘化钾试纸 | 变蓝 | Cl2具有氧化性 |
| D | 亚硫酸钠、硫酸 | 品红试液 | 褪色 | SO2具有还原性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取3.2gNaCl固体 | |
| B. | 用10mL量筒量取7.50mL稀盐酸 | |
| C. | 固体称量时,天平游码读数0.15g | |
| D. | 用广泛pH试纸测得某溶液的pH为3.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
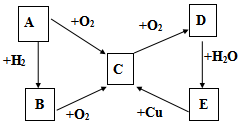 已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.
已知A、B、C、D、E五种物质有如图所示的转化关系(部分反应物及反应条件未列出,若解题时需要,可作合理假设),且五种物质中均含有A元素.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 摩尔是七个基本物理量之一 | |
| B. | 硫酸钠和水分别属于非电解质和弱电解质 | |
| C. | 硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物 | |
| D. | 分散系中分散质粒子的直径:Fe(OH)3浊液>Fe(OH)3胶体>FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
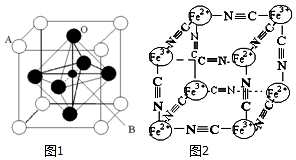 Ti、Fe、Cr、Mn等均为过渡元素,在生产生活中起着不可替代的重要作用,对其单质和化合物的应用研究是目前科学研究的前沿之一.请回答下列问题:
Ti、Fe、Cr、Mn等均为过渡元素,在生产生活中起着不可替代的重要作用,对其单质和化合物的应用研究是目前科学研究的前沿之一.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 某同学欲用下列装置探究碳与浓硫酸的反应,并对气体产物进行检验;
某同学欲用下列装置探究碳与浓硫酸的反应,并对气体产物进行检验;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com