
(15分)工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下:
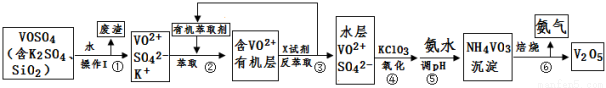
请回答下列问题:
(1)步骤①所得废渣的成分是 (写化学式),操作I的名称 。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+ 2nHA(有机层) 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是 。
③中X试剂为 。
(3)④的离子方程式为 。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
钒沉淀率% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.8 | 96.4 | 93.1 | 89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为 ;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)< 。〖已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39〗
(5)该工艺流程中,可以循环利用的物质有 和 。
(1)SiO2,过滤;(2)加入碱中和硫酸,促使平衡正向移动,提高钒的萃取率,H2SO4
(3)6VO2++ClO3-+9H2O=6VO3-+Cl-+18H+;(4)1.7~1.8 ,26×10-3mol/L;
(5)氨气(或氨水),有机萃取剂
【解析】
试题分析:(1)在K2SO4、SiO2、VOSO4中只有SiO2不能在水中溶解,因此步骤①所得废渣的成分是SiO2。将难溶性固体与溶液分离的操作是过滤。因此操作I的名称为过滤。(2)②中萃取时必须加入适量碱,其原因是加入碱中和前边反应产生的硫酸,促使平衡正向移动,提高钒的萃取率,③中X试剂为H2SO4。(3)在含有VO2+、SO42-的水在加入氧化剂KClO3可以把+4价的VO2+氧化为+5价的VO3-。因此根据电荷守恒及电子守恒,结合质量守恒定律,可知该步骤的离子方程式为6VO2++ClO3-+9H2O =6VO3 -+Cl-+ 18H+;(4)根据25℃时,钒沉淀率和溶液pH之间关系表格数据可知zai pH为1.7、1.8时钒沉淀率最高。因此调节溶液的最佳pH为1.7~1.8,若钒沉淀率为93.1%,则pH=2.0, c(H+)=10-2mol/L, c(OH-)=10-12,此时不产生Fe(OH)3沉淀,根据Ksp[Fe(OH)3]=2.6×10-39,则溶液中c(Fe3+)< Fe(OH)3÷c3(OH-) =2.6×10-39 ÷(10-12)3=2.6×10-3mol/L。(5)根据流程示意图可知:该工艺流程中,可以循环利用的物质有氨气(或氨水)和有机萃取剂。
考点:考查混合物的分离、实验条件的选择、离子方程式的书写、沉淀溶解平衡、物质的循环利用的知识。


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源:2013-2014湖南省五市十校高一下学期期中教学质量检测化学试卷(解析版) 题型:选择题
下列物质中含有共价键的离子化合物是
A.Ba(OH)2 B.CaCl2 C.H2OD.H2
查看答案和解析>>
科目:高中化学 来源:2013-2014湖南师大附中第二学期期中考试高一化学试卷(解析版) 题型:选择题
元素Y的原子获得3个电子或元素X的原子失去2个电子后,它们的电子层结构与氖原子的电子层结构相同,X、Y两种元素的单质在高温下得到的化合物的正确化学式是
A.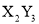 B.
B. C.
C. D.
D.
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省黄石市秋季高二化学期中统考试卷(解析版) 题型:选择题
一定温度下,某密闭容器里发生如下反应:CO(g)+H2O(g)  CO2(g)+H2(g) (正反应为放热反应),当反应达到平衡时,测得容器中各物质的物质的量均为 n mol。欲使H2的物质的量浓度增大1倍,在其他条件不变时,下列措施可采用的是( )
CO2(g)+H2(g) (正反应为放热反应),当反应达到平衡时,测得容器中各物质的物质的量均为 n mol。欲使H2的物质的量浓度增大1倍,在其他条件不变时,下列措施可采用的是( )
①升高温度 ②增大压强
③再通入n mol CO2和n mol H2 ④再加入2n mol CO和2n mol H2O(g)
A.①② B.②④ C.③④ D.①②③
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省黄石市秋季高二化学期中统考试卷(解析版) 题型:选择题
下列热化学方程式中,ΔH能正确表示物质的燃烧热的是( )
A.CO(g)+1/2O2(g)====CO2(g) ΔH=-283.0 kJ·mol-1
B.C(s)+1/2O2(g)====CO(g) ΔH=-110.5 kJ·mol-1
C.H2(g)+1/2O2(g)====H2O(g) ΔH=-241.8 kJ·mol-1
D.2C8H18(l)+25O2(g)====16CO2(g)+18 H2O(l) ΔH=-11036 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省高三5月模拟考试理综化学试卷(解析版) 题型:选择题
乙烯催化氧化成乙醛可设计成如图所示的燃料电池,能在制备乙醛的同时获得电能,其总反应为:2CH2=CH2+O2→2CH3CHO。下列有关说法正确的是:

A.该电池为可充电池
B.每有0.1molO2反应,则迁移0.4mol
C.正极反应式为:CH2=CH2-2e-+2OH-=CH3CHO+H2O
D.电子移动方向:电极a→磷酸溶液 →电极b
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省高一下学期期中联考化学试卷(解析版) 题型:填空题
(8分)(1)某温度时,在2 L密闭容器中,X、Y、Z三种物质的物质的量随时间变化曲线如下图所示。由图中数据分析,该反应的化学方程式为:____________________________
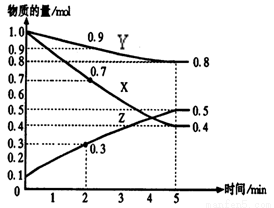
(2) 用Z表示从0—2min内该反应的平均反应速率为
____________________
(3) 某时刻t(t﹤5min)测得Y、Z两者的物质的量之比为
3:1,则X的转化率为_________
(4) 该条件下,能说明反应已达到平衡状态的是
a.容器内z物质的量浓度为0.25mol/L
b.正反应和逆反应的速率都为0
c.容器内X、Y、Z物质的量之比为1∶3∶2
d.容器内X气体的体积分数不变
e. 单位时间内消耗3a mol X,同时生成2a mol Z
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省高一下学期期中联考化学试卷(解析版) 题型:选择题
最近,意大利科学家使用普通氧分子和带正电荷的氧离子制造出了由4个氧原子构成的氧分子O4,并用质谱仪探测到了它存在的证据。下列说法正确的是
A.O4是氧元素的一种同位素
B.O4可能含有极性键
C.同温同压下,等体积的O4气体和O2含有相同的分子数
D.O4转化O2为物理变化
查看答案和解析>>
科目:高中化学 来源:2013-2014湖北省宜昌市高三5月模拟理综化学试卷(解析版) 题型:简答题
(14分)I.已知:C(s)+H2O(g) CO(g)+H2(g) ΔH
CO(g)+H2(g) ΔH
一定温度下,在1.0 L密闭容器中放入1 mol C(s)、1 mol H2O(g)进行反应,反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
总压强p/100 kPa | 4.56 | 5.14 | 5.87 | 6.30 | 7.24 | 8.16 | 8.18 | 8.20 | 8.20 |
回答下列问题:
(1)下列哪些选项可以说明该可逆反应已达平衡状态 。
A.混合气体的密度不再发生改变 B.消耗1 mol H2O(g)的同时生成1 mol H2
C.ΔH不变 D.v正(CO) = v逆(H2)
(2)由总压强P和起始压强P0表示反应体系的总物质的量n总,n总=____ mol;由表中数据计算反应达平衡时,反应物H2O(g)的转化率α =_____(精确到小数点后第二位)。
Ⅱ.硫单质及其化合物在工农业生产中有着重要的应用。
(1)已知25℃时:xSO2 (g)+2xCO(g)=2xCO2 (g)+Sx (s) ΔH=ax kJ/mol ①
2xCOS(g)+xSO2 (g)=2xCO2 (g)+3Sx (s) ΔH=bx kJ/mol。 ②
则反应COS(g)生成CO(g)、Sx (s)的热化学方程式是 。
(2)向等物质的量浓度Na2S、NaOH混合溶液中滴加稀盐酸至过量。其中H2S、HS?、S2?的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与滴加盐酸体积的关系如图所示(忽略滴加过程H2S气体的逸出)。试分析:
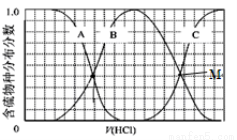
①B曲线代表 分数变化(用微粒符号表示);滴加过程中,溶液中一定成立:
c(Na+)= 。
②M点,溶液中主要涉及的离子方程式 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com