
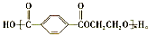
 .
.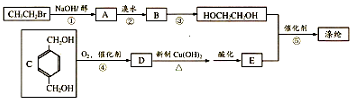
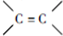 ,反应①、②的反应类型分别为消去反应、加成反应,有机物B的名称是1,2-二溴乙烷,反应③可用的试剂为氢氧化钠水溶液;
,反应①、②的反应类型分别为消去反应、加成反应,有机物B的名称是1,2-二溴乙烷,反应③可用的试剂为氢氧化钠水溶液;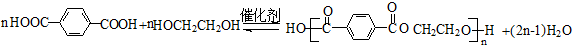 ;
;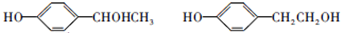 ;
; ;F的一种同系物G比F多2个碳原子,其中苯环上只有一个取代基的G的结构有4种.
;F的一种同系物G比F多2个碳原子,其中苯环上只有一个取代基的G的结构有4种. 分析 根据题中各物质转化关系,CH3CH2Br在氢氧化钠醇溶液中发生消去反应生成A为CH2=CH2,A与溴水发生加成反应得B为CH2BrCH2Br,B水解得CH2OHCH2OH,根据涤沦和CH2OHCH2OH的结构可知E为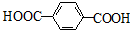 ,
,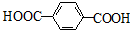 和CH2OHCH2OH发生缩聚反应得涤沦,D氧化、酸化得E,所以D为
和CH2OHCH2OH发生缩聚反应得涤沦,D氧化、酸化得E,所以D为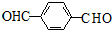 ,据此答题.
,据此答题.
解答 解:根据题中各物质转化关系,CH3CH2Br在氢氧化钠醇溶液中发生消去反应生成A为CH2=CH2,A与溴水发生加成反应得B为CH2BrCH2Br,B水解得CH2OHCH2OH,根据涤沦和CH2OHCH2OH的结构可知E为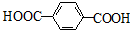 ,
,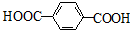 和CH2OHCH2OH发生缩聚反应得涤沦,D氧化、酸化得E,所以D为
和CH2OHCH2OH发生缩聚反应得涤沦,D氧化、酸化得E,所以D为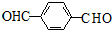 ,
,
(1)A为CH2=CH2,A中官能团的结构式为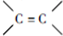 ,反应①为消去反应,反应②为加成反应,B为CH2BrCH2Br,B的名称是1,2-二溴乙烷,反应③为卤代烃的碱性水解,可用的试剂为氢氧化钠水溶液,
,反应①为消去反应,反应②为加成反应,B为CH2BrCH2Br,B的名称是1,2-二溴乙烷,反应③为卤代烃的碱性水解,可用的试剂为氢氧化钠水溶液,
故答案为: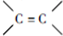 ;消去反应;加成反应;1,2-二溴乙烷;氢氧化钠水溶液;
;消去反应;加成反应;1,2-二溴乙烷;氢氧化钠水溶液;
(2)反应⑤的化学方程式为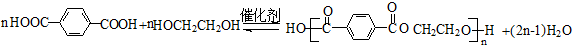 ,
,
故答案为: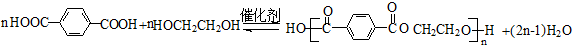 ;
;
(3)D为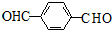 ,分子中有两个醛基,所以1molD与足量银氨溶液反应,可得到4mol银单质,
,分子中有两个醛基,所以1molD与足量银氨溶液反应,可得到4mol银单质,
故答案为:4;
(4)有机物C的同分异构体中,含有苯环,并同时符合下列条件a.能发生消去反应,说明羟基邻位碳上有氢原子,b.能与浓溴水反应生成白色沉淀,说明酚羟基邻或对位碳上有氢原子,c.核磁共振氢谱有6个峰即有6种位置的氢原子,符合条件的结构简式为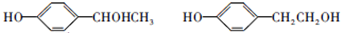 ,
,
故答案为: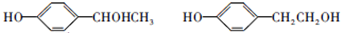 ;
;
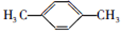
(5)工业上常用烃F直接氧化来制取有机物E,已知:F的分子式为C8H10,则其结构简式为  ;F的一种同系物G比F多2个碳原子,其中苯环上只有一个取代基的G的结构为苯环上分别连有-CH2CH2CH2CH3、-CH(CH3)CH2CH3、-CH2CH(CH3)2、-C(CH3)3,有4 种,
;F的一种同系物G比F多2个碳原子,其中苯环上只有一个取代基的G的结构为苯环上分别连有-CH2CH2CH2CH3、-CH(CH3)CH2CH3、-CH2CH(CH3)2、-C(CH3)3,有4 种,
故答案为: ;4.
;4.
点评 本题考查有机推断,涉及烯烃、卤代烃、醇、醛、羧酸等性质以及学生推理能力等,是对有机化合物知识的综合考查,能较好的考查考生的思维能力,难度中等,是高考热点题型.


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 一定是IIA元素 | |
| B. | 一定是金属元素 | |
| C. | 一定是正二价元素 | |
| D. | 可能是金属元素,也可能是非金属元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li是最轻的金属,也是活动性极强的金属,是制造电池的理想物质 | |
| B. | 燃料电池的能量转化率可达100% | |
| C. | 电解质为NH4Cl的锌锰干电池比电解质KOH锌锰干电池使用寿命长 | |
| D. | 钢铁在海水中比在河水中更易被腐蚀,主要原因是海水含氧量高 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7:17 | B. | 3:2 | C. | 12:1 | D. | 7:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
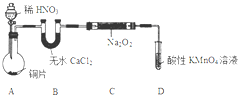 亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,但使用过量会使人中毒.某学习小组针对亚硝酸钠设计了如下实验:
亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,但使用过量会使人中毒.某学习小组针对亚硝酸钠设计了如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用饱和氯化铵溶液可以清洗金属表面的锈 | |
| B. | NOx、Cl2、PM2.5颗粒都会导致酸雨 | |
| C. | 在食品袋中放入盛有硅胶的透气小袋,可防止食物受潮 | |
| D. | 人体摄入大量铝盐易患“老年性痴呆”,明矾不宜大量作净水剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝热剂用于焊接钢轨 | B. | 过氧化钠用于呼吸面具供氧 | ||
| C. | 湿润红色石蕊试纸检验氨气 | D. | 湿润的淀粉碘化钾试纸检验氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定存在Fe2+、Na+、Cl- | B. | 一定不存在I-、SO32- | ||
| C. | 一定呈碱性 | D. | 一定存在NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com