
【题目】T℃时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为:![]() ,有关该平衡体系的说法正确的是
,有关该平衡体系的说法正确的是
A. 该反应可表示为X(g) + 2Y(g)![]() 2Z(g) + 2W(g)
2Z(g) + 2W(g)
B. 减小X浓度,平衡向逆反应方向移动,平衡常数K减小
C. 增大反应容器的压强,该反应速率一定增大
D. 升高温度,W(g)体积分数增加,则正反应是放热反应
【答案】D
【解析】试题分析:A.由于化学平衡常数是可逆反应达到平衡状态时各生成物浓度幂指数的乘积与各反应物浓度幂指数乘积的比。所以该反应可表示为2Z(g) + 2W(g)![]() X(g) + 2Y(g)。错误。B. 减小X浓度,平衡向正反应方向移动,但是由于反应的温度不变,所以化学平衡常数K不变。错误。C.若容器的容积不变,向容器内冲入与体系无关的气体而增大反应容器的压强,由于各物质的浓度没变,所以该反应速率不变;若缩小容器的容积,使物质的浓度增大,则化学反应速率加快。错误。D.根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动。由于W(g)体积分数增加,则升高温度平衡逆向移动逆反应为吸热反应。则正反应是放热反应。正确。
X(g) + 2Y(g)。错误。B. 减小X浓度,平衡向正反应方向移动,但是由于反应的温度不变,所以化学平衡常数K不变。错误。C.若容器的容积不变,向容器内冲入与体系无关的气体而增大反应容器的压强,由于各物质的浓度没变,所以该反应速率不变;若缩小容器的容积,使物质的浓度增大,则化学反应速率加快。错误。D.根据平衡移动原理:升高温度,化学平衡向吸热反应方向移动。由于W(g)体积分数增加,则升高温度平衡逆向移动逆反应为吸热反应。则正反应是放热反应。正确。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在容积为1L的密闭容器中,充入1mol CO2和3mol H2,在温度500℃时发生反应:CO2(g)+ 3H2(g)![]() CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图,下列说法不正确的是
CH3OH(g)+ H2O(g) △H<0。CH3OH的浓度随时间变化如图,下列说法不正确的是
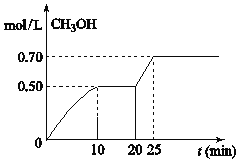
A.从反应开始到10分钟时,H2的平均反应速率v(H2)=0.15 mol/(L·min)
B.从20分钟到25分钟达到新的平衡,可能是增大压强
C.其它条件不变,将温度升到800℃,再次达平衡时平衡常数减小
D.从开始到25分钟,CO2的转化率是70%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了区别CO(可能混有氧气)与CO2两瓶无色气体,下列方法中可行的是
A. 伸入燃着的木条。
B. 分别通入少量澄清石灰水,振荡。
C. 分别通入少量NaOH溶液,振荡。
D. 分别通入少量稀硫酸,振荡。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解9.6 g。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸只被还原为NO气体)。下列分析或结果错误的是

A.原混合酸中NO3-物质的量为0.1 mol
B.OA段产生的是NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气
C.第二份溶液中最终溶质为FeSO4
D.H2SO4浓度为2.5 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于微观粒子的说法,正确的是
A. 原子是由分子构成的。
B. 原子中含有质子、中子和核外电子。
C. 原子若失去核外电子,则会变成阴离子。
D. 原子若得到核外电子,则会变成阳离子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
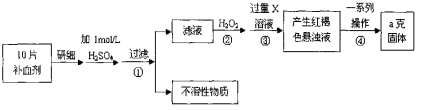
请回答下列问题:
(1) 步骤①滤液中滴加KSCN溶液后滤液变为红色,则该溶液中含有 (填离子符号),检验滤液中还存在Fe2+的方法为 (注明试剂、现象)。
(2) 步骤②加入过量H2O2的目的是 。
(3) 步骤③中反应的离子方程式为 。
(4) 步骤④中一系列处理的操作步骤包括:过滤、 、灼烧、 、称量。
(5) 若实验无损耗,则每片补血剂含铁元素的质量为 g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中氢离子浓度最小的是
A. 10L0.10mol/LCH3COOH 溶液 B. 2L 0.05mol/L H2SO4溶液
C. lL0.10mol/LHNO3溶液 D. 2L0.1mol/LHCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含SiO2、Fe2O3等杂质)为原料冶炼铝的工艺流程如下图所示:

已知:2Na2SiO3+2NaAlO2+2H2O=Na2Al2SiO3↓+4NaOH。对上述流程中的判断正确的是
①试剂X为稀硫酸,沉淀中含有硅的化合物
②反应II中生成Al(OH)3的反应为:CO2+AlO2-+2H2O═Al(OH)3↓+HCO3-
③结合质子(H+)的能力:OH->AlO2->CO32-
④Al2O3熔点很高,工业上还可采用电解熔融AlCl3冶炼Al
A. ①② B. ②③ C. ①④ D. ③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com